Guidelines & Standards
Evidence 2018;10(9): e1000187 doi: 10.4470/E1000187
Pubblicato: 15 ottobre 2018
Copyright: © 2017 American Medical Association -
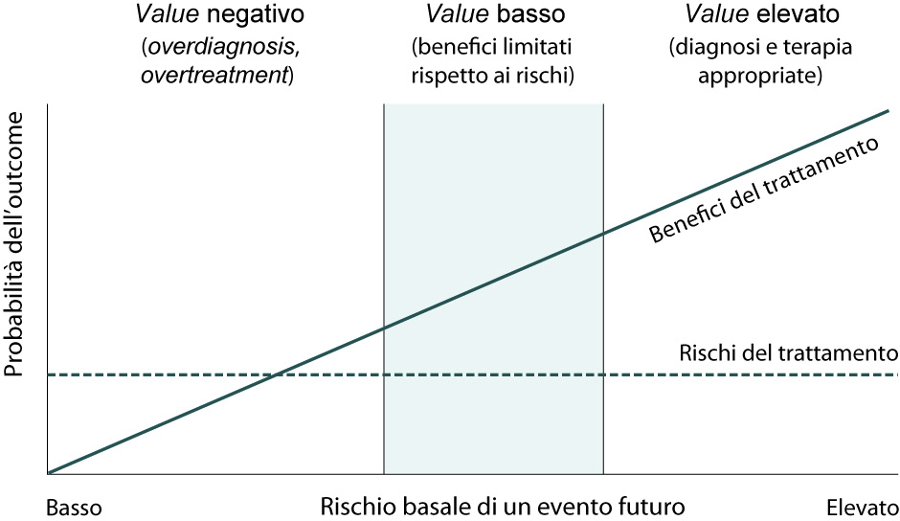
A livello internazionale cresce lâinteresse sulle conseguenze dellâoverdiagnosis, ovvero diagnosi di malattia che determinano effetti avversi maggiori dei benefici (1). Lâestensione delle definizioni di malattia (2), se da un lato può determinare benefici per i pazienti che possono accedere a trattamenti efficaci, dallâaltro rappresenta uno dei driver principali dellâoverdiagnosis, tanto più rilevante quanto più lâestensione delle definizioni include stadi di malattia precoci o più lievi. Infatti, il beneficio terapeutico assoluto di solito è direttamente proporzionale alla severità della malattia o al rischio di base (3), una relazione dimostrata sia per lâipercolesterolemia (4) che per lâipertensione (5). Al contrario, la probabilità di effetti avversi è generalmente costante e indipendente dal rischio di base, poiché questi costituiscono un effetto fisso dellâintervento terapeutico. Di conseguenza, nei pazienti ai quali viene diagnosticata una patologia in fase precoce o lieve, gli effetti avversi sono spesso più probabili dei benefici (figura 1).
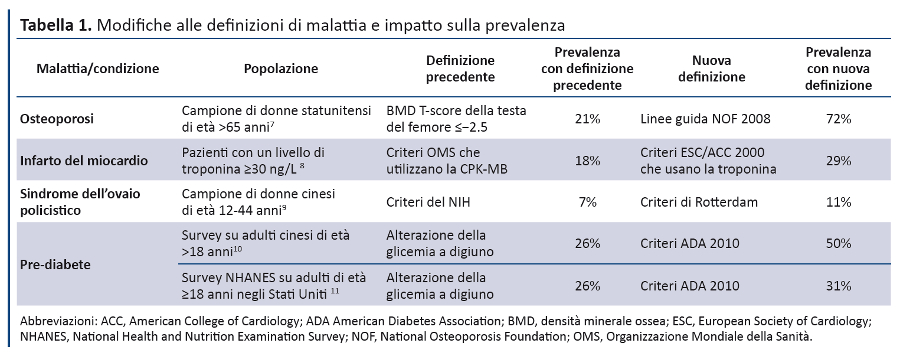
Uno studio recente (6) ha evidenziato la tendenza dei panel che elaborano linee guida ad estendere le definizioni di malattia. Nessuna delle 16 linee guida includeva una valutazione rigorosa dei potenziali effetti avversi delle modifiche proposte, nè dellâimpatto sulla prevalenza delle malattie (tabella 1).
I report della serie Less is More pubblicati su JAMA Internal Medicine (12) e della serie Too much Medicine sul British Medical Journal (13) dimostrano che lâestensione delle definizioni di malattia è un fenomeno comune a tutte le specialità mediche e che le modalità attuali non sono adeguate per identificare e prevenire eventuali modifiche inappropriate.
Nonostante il notevole impatto dei cambiamenti delle definizioni di malattia, non è stato possibile identificare alcun criterio condiviso per effettuare tali modifiche. In particolare, anche se spesso le malattie non hanno confini ben definiti ed è richiesto un determinato grado di giudizio per stabilire la soglia diagnostica, attualmente non esistono molti strumenti per guidare i panel a prendere queste decisioni, in contrasto con gli standard disponibili per produrre linee guida per la pratica clinica valide e trasparenti14,15. Il Guidelines International Network (G-I-N) â che include 107 organizzazioni e che mira a guidare, rafforzare e supportare la collaborazione nella produzione, adattamento e implementazione di linee guida â, riconoscendo la necessità di affrontare questa sfida (13), ha costituito un gruppo di lavoro finalizzato a sviluppare raccomandazioni per modificare le definizioni di malattia tramite una checklist di 8 item.
Metodi
Al fine di elaborare il documento è stato costituito un gruppo di lavoro multidisciplinare di 13 membri provenienti da tutti i continenti. Sono stati inclusi professionisti con competenze ed esperienze specifiche in tassonomia, epidemiologia, patologia, genetica ed esperti dello sviluppo di linee guida con differente background, tra cui alcuni componenti del gruppo di lavoro GRADE e dellâOrganizzazione Mondiale della Sanità (OMS). Lâelaborazione della checklist è stata guidata dal framework metodologico realizzato dallâEQUATOR Network per sviluppare linee guida per il reporting (16): (1) revisione sistematica della letteratura, (2) stesura di una bozza, (3) survey e processo di consenso con metodo Delphi, (4) meeting face-to-face di un giorno e (5) modifiche finali alla checklist.
La ricerca bibliografica è stata effettuata nel database Scopus utilizzando la tecnica iterativa âa valangaâ, partendo da 4 articoli principali (17-20). à stato diffuso tra i componenti del gruppo di lavoro un elenco delle criticità identificate e quindi condotta una survey su 36 membri del G-I-N e 40 membri del gruppo di lavoro GRADE selezionati in maniera casuale. Tramite un questionario strutturato a risposta aperta è stato chiesto di giudicare la rilevanza di ciascuna criticità utilizzando una scala di Likert a 4 punti, oltre che di inserire eventuali commenti.
Nel meeting il gruppo di lavoro ha discusso dei problemi emersi con la ricerca bibliografica e con i feedback della survey per determinare struttura, sequenza degli item e terminologia della checklist. Il gruppo ha selezionato un esempio per illustrare lâutilizzo della checklist: la recente definizione del diabete mellito gestazionale (GDM) da parte di un panel norvegese che ha prodotto una linea guida.
Infine, la checklist è stata fatta circolare tra i membri del gruppo di lavoro per ulteriori chiarimenti e revisioni. La checklist finale, il razionale per lâinclusione e le evidenze per ciascun item sono riportati di seguito.
Risultati
La ricerca bibliografica iniziale ha identificato 99 citazioni rilevanti da cui sono emerse raccomandazioni limitate su come modificare la definizione di malattia, perchè la maggior parte degli articoli identificati trattano dei problemi reali o potenziali conseguenti alla modifica delle definizioni di malattia. Le criticità identificate sono state: chiarezza della definizione, potenziale errato utilizzo, consistenza, effetti su incidenza e prevalenza della malattia, modifiche alla storia naturale della malattia, efficacia del trattamento, effetti avversi inclusi quelli psicologici ed economici, utilità della definizione di malattia a livello individuale e sociale.
Da queste criticità e dai feedback della survey, il gruppo di lavoro ha sviluppato una checklist a 7 item, a cui successivamente è stato aggiunto un item finale sul bilancio complessivo dei potenziali benefici e rischi. La tabella 2 riporta la checklist insieme al razionale di ciascun item.
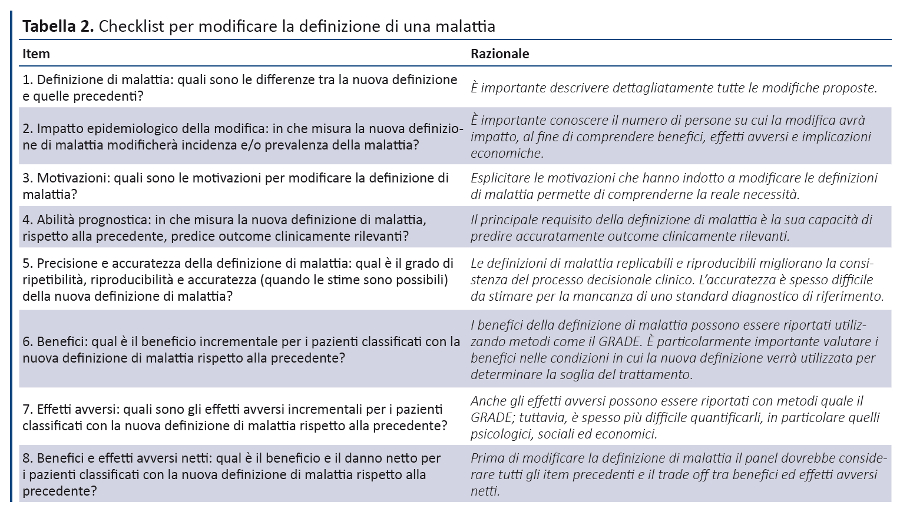
1. Differenze tra la nuova definizione e le precedenti
Il panel deve descrivere in maniera esplicita la nuova definizione di malattia e le precedenti definizioni, sottolineando le differenze. Nel caso in cui le definizioni precedenti non fossero standardizzate, occorre descrivere quelle prevalentemente utilizzate.
2. Impatto epidemiologico su incidenza e/o prevalenza della malattia
Il panel deve descrivere gli effetti delle modifiche proposte sullâincidenza e/o la prevalenza della malattia, perchè modifiche apparentemente minori possono avere un impatto rilevante sulla prevalenza (tabella 1). Abbassando la soglia di malattia vengono inclusi tutti i pazienti precedentemente diagnosticati (figura 2, A). Al contrario, innalzare la soglia di malattia determina una riduzione del numero di pazienti (figura 2, B), anche se è una evenienza di gran lunga meno frequente. Quando viene modificato il metodo di definizione di una malattia, e non esclusivamente la soglia, negli studi di prevalenza è necessario classificare i pazienti con entrambe le definizioni, per verificare eventuali concordanze e discordanze. Considerato che la modifica dei test diagnostici può identificare pazienti diversi, lâincidenza della malattia può risultare ridotta (figura 2, D), invariata (figura 2, E), ma più frequentemente aumentata (figura 2, C). Ad esempio, nel 2000 la modifica della definizione dei criteri diagnostici per lâinfarto miocardico ha aumentato lâincidenza del 61% circa e modificato il mix di pazienti: infatti il 9% di quelli precedentemente diagnosticati utilizzando la CPK-MB non vengono più identificati usando la troponina8. Analogamente câè una sovrapposizione limitata tra diagnosi/non diagnosi di prediabete utilizzando differenti test diagnostici (emoglobina glicata, alterazioni della glicemia a digiuno, ridotta tolleranza al glucosio), con notevole variazione del grado di sovrapposizione tra gruppi etnici (11).
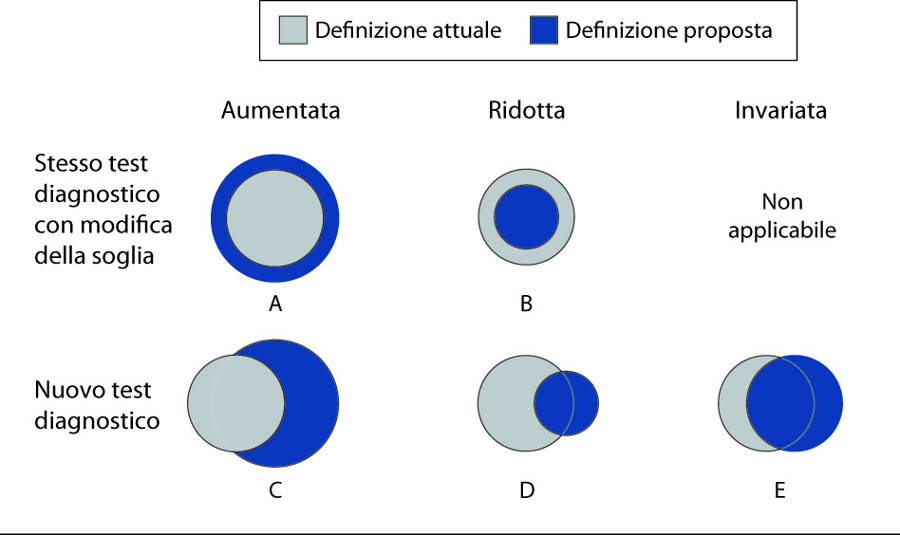
Gli studi che valutano le modifiche dellâincidenza o della prevalenza dovrebbero essere condotti nei rispettivi contesti clinici utilizzando i metodi di misurazione utilizzati nella pratica clinica. Ad esempio, sperimentazioni successive alla revisione della definizione del disturbo da deficit di attenzione e iperattività nella IV edizione del DSM hanno stimato un aumento della prevalenza del 15% in centri di ricerca universitari (21); un valore ampiamente sottostimato quando la nuova definizione viene applicata in contesti clinici più ampi (22).
3. Motivazioni per modificare la definizione di malattia
Enfatizzare le motivazioni che hanno indotto a modificare la definizione di malattia permette di comprenderne meglio la necessità . Le ragioni del panel per modificare la definizione di malattia possono essere diverse: disponibilità di nuove terapie con evidenti benefici per i pazienti identificati dalla nuova definizione, sviluppo di un nuovo test diagnostico, nuove evidenze sulla prognosi, necessità di standardizzare definizioni tra differenti setting clinici o per obiettivi di ricerca, maggiore chiarezza o precisione nella definizione di malattia.
4. Modifica dellâabilità prognostica
Un paziente trae beneficio dalla diagnosi di una malattia solo se questa permette di comprendere la sintomatologia o il rischio di eventi clinicamente rilevanti, o se il paziente può trarre beneficio da uno specifico trattamento. Per valutare i potenziali benefici ed effetti avversi della modifica di definizione di malattia, è necessario conoscere la storia naturale dei pazienti identificati con la nuova definizione, ma non da quella precedente (aree in grigio della figura 2). Lâevent rate in tutti i pazienti diagnosticati non è sufficiente a comprendere la storia naturale della malattia in questi ânuoviâ pazienti e può celare differenze importanti. Se la prognosi dei ânuoviâ pazienti è migliore rispetto a quelli classificati con la definizione precedente, la prognosi media di tutti i pazienti classificati con la nuova definizione sarà migliore. Per tale ragione le linee guida basate sulle precedenti definizioni non possono essere applicate incondizionatamente ai ânuoviâ pazienti.
La conoscenza della storia naturale della malattia deriva idealmente da coorti prospettiche ben disegnate (23). à necessario prestare molta attenzione ai potenziali effetti confondenti dal trattamento, perché la terapia di pazienti attualmente etichettati con la condizione può ridurre lâevent rate e causare false associazioni (24). Trial randomizzati con un braccio di non trattamento o sottoposto a un trattamento standard possono fornire informazioni a proposito della capacità della definizione di malattia di predire sia eventi clinicamente importanti (abilità prognostica) sia la risposta alle decisioni terapeutiche (abilità predittiva) (25). Tuttavia, occorre cautela sulla generalizzabilità dei risultati considerata la crescente rigidità dei criteri di inclusione nei trial.
Molte definizioni di malattia si basano su end-point surrogati che non sempre migliorano lâabilità prognostica. Ad esempio, in una revisione di modelli di rischio del diabete, la diagnosi di prediabete basata sullâalterazione dei valori glicemici non è molto accurata nel predire lo sviluppo successivo del diabete (26,27).
5. Ripetibilità , riproducibilità e accuratezza
I criteri utilizzati per classificare i pazienti con una nuova definizione di malattia possono essere visti come un test diagnostico. Tuttavia, considerato che raramente è disponibile un gold standard appropriato, le misure di accuratezza (es. sensibilità , specificità , valori predittivi, etc) saranno difficilmente misurabili.
Anche se lâaccuratezza non può essere necessariamente stimata, la precisione della nuova definizione di malattia dovrebbe invece essere considerata, perché definizioni di malattia poco precise determinano diagnosi inconsistenti e sono di scarsa utilità clinica. Misure di precisione includono la ripetibilità (accordo in condizioni identiche) e la riproducibilità (accordo in condizioni comparabili). La variazione osservata attorno alla soglia della malattia è la più rilevante.
La performance di una definizione di malattia non può essere facilmente distinta dai metodi di misurazione utilizzati. Ad esempio, una limitata precisione può conseguire a variazioni biologiche (es. quelle della pressione arteriosa nelle 24 ore o tra giorni diversi) o a variazioni analitiche (es. precisione dello sfigmomanometro nel misurare la reale pressione arteriosa). à possibile aumentare la precisione utilizzando la media di varie misurazioni o standardizzando la procedura di test. Ad esempio, standardizzare lâesame dellâormone paratiroideo può ridurre lâerrata classificazione dei pazienti con iperparatiroidismo secondario (28). La precisione idealmente dovrebbe essere valutata in contesti reali utilizzando gli stessi metodi di misurazione utilizzati nella pratica clinica.
6. Benefici incrementali
Se modificare la definizione di malattia modifica il numero di pazienti che ricevono il trattamento, è fondamentale stimarne benefici ed effetti avversi, concentrandosi sui pazienti diagnosticati con la nuova definizione e non su quelli identificacti con la precedente (aree più chiare della figura 2). Modifiche alle definizioni di malattia possono indubbiamente determinare benefici per il paziente, in particolare permettendo lâutilizzo di terapie efficaci. Ad esempio, la revisione della definizione di artrite reumatoide del 2010 permette una diagnosi precoce e un trattamento tempestivo, che può ridurre il rischio di erosioni articolari (29). In ogni caso, il gruppo di lavoro ha riconosciuto che le evidenze da trial precedenti in pazienti con malattia in fase più avanzata o più severa non possono essere applicate a quelli con patologie più lievi o meno severe; rimangono pertanto perplessità sullâerrata classificazione (30).
Criteri diagnostici che migliorano lâabilità prognostica sono utili, ma non sufficienti ad assicurare miglioramenti negli outcome di salute, poiché i marker prognostici possono non classificare adeguatamente i pazienti per le decisioni terapeutiche (31). Ad esempio, lâanalisi del profilo molecolare è un test promettente per selezionare le pazienti con carcinoma della mammella da trattare, ma i benefici netti dellâutilizzo di questi marker per guidare le decisioni cliniche sono ancora incerti (32).
I panel per lo sviluppo di linee guida possono avere necessità di considerare altri benefici, tra cui outcome non clinici: ad esempio, una diagnosi di malattia può validare i sintomi e garantire lâaccesso a benefici sociali o di altra natura.
7. Effetti avversi incrementali
I potenziali effetti avversi conseguenti alla diagnosi includono i danni fisici di test diagnostici e trattamenti, gli effetti psicologici (es. ansia), le conseguenze sociali (es. stigma, discriminazione) e quelle finanziarie (es. impatto sullâoccupazione). Nel caso delle malattie genetiche, tali effetti possono estendersi ai familiari. Solitamente, gli effetti avversi non vengono adeguatamente misurati nei trial clinici e quelli osservati nelle popolazioni in studio possono non riflettere quelli dellâintera popolazione (33). Possibili effetti avversi includono lâutilizzo non corretto e lâerrata interpretazione della definizione di malattia, se estesa da un ristretto campo di ricerca ad un più ampio utilizzo clinico.
Modifiche nellâallocazione delle risorse possono determinare effetti avversi riducendo lâaccesso allâassistenza per alcuni pazienti e determinando deviazione e distrazione delle priorità clinico-assistenziali. Questo può verificarsi sia a livello di sistema sanitario, tramite una riallocazione delle risorse da aree più rilevanti per la salute ad aree meno rilevanti, sia a livello individuale distraendo le persone da attività più rilevanti per la loro salute e benessere individuali. La modifica delle definizioni di malattia può avere un impatto considerevole sulle risorse, sia quelle necessarie per i test diagnostici, sia per il trattamento e il follow-up dei pazienti diagnosticati con i nuovi criteri. Possono essere necessarie anche risorse per la formazione e lâimplementazione al cambiamento e per minimizzare gli errori diagnostici. Lâimpatto economico può essere particolarmente rilevante nei paesi a basso e medio reddito dove definizioni inappropriate di malattia possono determinare una considerevole riallocazione impropria di risorse.
8. Bilanciare benefici ed effetti avversi netti
Quando si modifica la definizione di una malattia bisogna lasciarsi guidare da una valutazione equilibrata di benefici ed effetti avversi attesi, utilizzando le migliori evidenze disponibili. La definizione dovrebbe riflettere i valori e le preferenze dei pazienti e della società , oltre che prendere in considerazone lâimpatto economico. Si raccomanda lâutilizzo di un processo trasparente ed esplicito, come il metodo GRADE, utilizzando sintesi strutturate delle evidenze per documentare gli effetti assoluti relativi ad outcome rilevanti per i pazienti (34).
Le analisi decisionali costituiscono uno strumento pratico per modellare potenziali benefici e effetti avversi dei cambiamenti proposti nelle definizioni di malattia. I modelli possono utilizzare dati da trial esistenti con adeguati aggiustamenti per le differenze nel rischio di base.
Se la nuova definizione di malattia sarà utilizzata esclusivamente per scopi di ricerca, la stima di benefici e effetti avversi del trattamento potrebbe non essere necessaria. Può essere opportuno utilizzare definizioni differenti tra obiettivi di ricerca (es. standardizzazione più rigorosa) e clinico-assistenziali, dove definizioni più restrittive potrebbero impedire lâaccesso alle cure ai pazienti che ne trarrebbero vantaggio. In generale, si raccomanda ai panel di:
- prendere in considerazione sia un approccio individuale che collettivo per stimare il profilo rischio-beneficio della modifica delle definizioni di malattia;
- introdurre una nuova definizione di malattia quando tale profilo rischio-beneficio è favorevole sia a livello individuale che collettivo.
Discussione
Le evidenze scientifiche disponibili per guidare la modifica delle definizioni di malattia sono ancora limitate. La checklist proposta fornisce un framework concettuale per guidare tali decisioni e incoraggiare la trasparenza nel processo decisionale sulle incertezze e i trade-off. Segue un approccio simile a quello usato dai gruppi di lavoro GRADE per valutare altri interventi sanitari, ma considera esplicitamente le necessità di modificare le definizioni di malattia. I panel di linee guida per la pratica clinica ed altri gruppi di lavoro dovrebbero utilizzare la checklist come reminder degli aspetti rilevanti da considerare e per comunicare motivazioni della nuova definizione di malattia e variazioni apportate.
Modificare le definizioni di malattia può avere benefici sia per i medici che per i pazienti: maggiore consistenza nel processo decisionale, standardizzazione dei processi per migliorare comunicazione e ricerca, maggior accesso a trattamenti efficaci per i pazienti. Tuttavia, considerato che i potenziali rischi di overdiagnosis e overtreatment impongono cautela per garantire che i pazienti non vengano danneggiati, le definizioni di malattia dovrebbero essere modificate solo quando esistono consistenti evidenze di benefici.
Una recente revisione ha dimostrato che i panel di linee guida ampliano le definizioni di malattia senza considerare in maniera rigorosa i problemi inclusi nella checklist. Preoccupazioni sullâoverdiagnosis e sui potenziali effetti avversi di trattare pazienti con la nuova definizione di malattia sono stati sollevati per varie condizioni incluse nella revisione del 2013, come ADHD e ipertensione (35,36), e persistono per molte altre condizioni come insufficienza renale cronica, osteoporosi e prediabete.
Limiti
Le modifiche alle definizioni di malattia potrebbero non avere alcuna implicazione terapeutica, come accaduto per la definizione della malattia di Alzheimer in fase preclinica (37). Nella maggior parte dei casi, tuttavia, lâampliamento della definizione di malattia costituisce un driver per ampliare le indicazioni terapeutiche.
Allâinterno dei panel che modificano le definizioni di malattia possono essere presenti membri con rilevanti conflitti dâinteresse sia finanziari (6), sia di natura intellettuale ed emotiva altrettanto difficili da gestire.
La checklist non mira a risolvere lâattuale combinazione tra fattori di rischio ed entità nosologiche di malattie sintomatiche che si è diffusa nella medicina moderna (38,39), una distinzione che dovrebbe essere presa in considerazione e perfezionata nelle future revisioni della checklist.
La checklist è stata sviluppata tramite un processo di consultazione con esperti provenienti dal differente background culturale, ma non è ancora stata sperimentata o validata. Di conseguenza, è opportuno che i panel che modificano le definizioni di malattia utilizzino la checklist, fornendo i loro feedback.
Conclusioni
La checklist rappresenta un primo step per guidare e documentare in maniera più accurata le modifiche delle definizioni di malattia. Sono necessari ulteriori sforzi per chiarire i metodi e guidare il giudizio sullâadeguatezza delle evidenze e sul profilo-rischio-beneficio. Un gruppo di lavoro G-I-N continuerà a lavorare in tal senso.
Membri del Guidelines International Network Preventing Overdiagnosis Working Group
Jenny Doust, Centre for Research in Evidence Based Practice, Bond University, Australia; Per O. Vandvik, Department of Medicine, Innlandet Hospital Trust, Gjøvik, Norvegia; Amir Qaseem, Department of Clinical Policy, American College of Physicians, Philadelphia, USA; Reem A. Mustafa, Department of Health Research Methods, Evidence and Impact, McMaster University, Hamilton, Canada e Department of Medicine, McMaster University, Hamilton, Canada; Andrea R. Horvath, NSW Health Pathology SEALS Department of Clinical Chemistry and Endocrinology, Prince of Wales Hospital, Sydney, Australia; Allen Frances, Duke University, Durham, USA; Lubna Al-Ansary, Department of Family and Community Medicine, King Saud University, Riyadh, Arabia Saudita; Patrick Bossuyt, Department of Clinical Epidemiology and Biostatistics, University of Amsterdam, Amsterdam, Paesi Bassi; Robyn L. Ward, , Brian Wilson Chancellery, University of Queensland, St Lucia, Australia; Ina Kopp, Association of the Scientific Medical Societies´ Institute of Medical Knowledge-Management (AWMF-IMWi), Philipps-University, Marburg, Germania; Laragh Gollogly, MD, Department of Strategy, Policy, and Information, Organizzazione Mondiale della Sanità , Ginevra, Svizzera; Holger Schunemann, Department of Health Research Methods, Evidence and Impact, McMaster University, Hamilton, Canada; Paul Glasziou, Centre for Research in Evidence Based Practice, Bond University, Australia.



