Position Statement GIMBE
Evidence 2017;9(9): e1000173 doi: 10.4470/E1000173
Pubblicato: 28 novembre 2017
Copyright: Š 2017 Cartabellotta et al. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente lâutilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Lâutilizzo della cannabis a scopo terapeutico è sempre piĂš diffuso a livello internazionale (1,2). In Italia, sin dal 1998 i medici sono autorizzati a prescrivere preparazioni magistrali a base di cannabis per uso terapeutico, tramite ricetta non ripetibile (3). Successivamente, con il DM 23 gennaio 2013 (4) il Ministero della Salute ha inserito nella sezione B della Tabella dei Medicinali i medicinali stupefacenti di origine vegetale a base di cannabis: sostanze e preparazioni vegetali, inclusi estratti e tinture. Il medico può dunque oggi prescrivere prodotti a base di cannabis a fini terapeutici e qualsiasi farmacia, se rifornita della sostanza, può dispensare prodotti a base di cannabis sotto forma e dose di medicamento secondo prescrizione medica.
Nel corso dellâultimo anno lâutilizzo della cannabis a fini terapeutici è al centro del dibattito politico e sociale nel nostro Paese. In particolare, il DdL S.2947 âDisposizioni concernenti la coltivazione e la somministrazione della cannabis a uso medicoâ (5) è approdato lo scorso 30 ottobre al Senato, dopo lâapprovazione alla Camera che ha unificato nel passaggio alla Camera i testi di tutti i DdL simili giĂ presentati. Inoltre, secondo quanto previsto dallâaccordo di collaborazione tra Ministero della Salute e Ministero della Difesa del 18 settembre 2014 (6) è stata avviata in Italia la produzione della cannabis, in precedenza importata da coltivazioni olandesi tramite lâOffice of Medicinal Cannabis. Infatti, dal 14 dicembre 2016 (7) è disponibile per la prescrizione di preparazioni magistrali a base di cannabis la sostanza attiva di origine vegetale cannabis FM2 prodotta dallo Stabilimento Chimico Farmaceutico Militare di Firenze secondo le Good Manufacturing Practices (GMP) dellâUnione Europea (8). La cannabis FM2 è costituita da infiorescenze femminili non fecondate, essiccate e macinate contenenti una percentuale di tetraidrocannabinolo (THC) del 5-8% e ad una di cannabidiolo (CBD) del 7,5-12%; sono inoltre presenti cannabigerolo, cannabicromene e tetraidrocannabivarina in percentuale <1%. La cannabis FM2 coltivata in Good Agricoltural and Collecting Practices (GACP) e prodotta secondo le GMP è fabbricata in accordo con le direttive dellâUnione Europea in materia di sostanze attive per la produzione di medicinali. La documentazione tecnica del prodotto è depositata presso lâAgenzia Italiana del Farmaco.
La Direzione Generale dei Dispositivi Medici e del Servizio Farmaceutico del Ministero della Salute â il cui Ufficio Centrale Stupefacenti con lâentrata in vigore del DM 9 novembre 2015 svolge le funzioni di Organismo statale per la cannabis (9) â ha emanato una circolare con tutte le informazioni necessarie a medici e farmacisti per lâutilizzo della cannabis FM2 a scopi terapeutici (10): prescrizione e rimborsabilitĂ , monitoraggio delle prescrizioni, indicazioni, posologia e metodo di somministrazione, modalitĂ di preparazione del decotto, proprietĂ farmacodinamiche e farmacocinetiche, controindicazioni, effetti collaterali, avvertenze speciali e precauzioni di impiego, interazioni con altri medicinali ed altre forme di interazione, sistema di fitosorveglianza per il monitoraggio della sicurezza. La circolare ribadisce che âla cannabis non può essere considerata una terapia propriamente detta, ma un trattamento sintomatico di supporto a quelli standard, quando questi non hanno prodotto gli effetti desiderati o hanno provocato effetti secondari non tollerabili o necessitano di incrementi posologici che potrebbero determinare la comparsa di effetti collateraliâ. Tenendo conto delle evidenze scientifiche disponibili, che saranno aggiornate ogni due anni, la circolare riporta le condizioni nelle quali è previsto lâutilizzo di cannabis ad uso medico (box 1). Le preparazioni magistrali a base di cannabis FM2 possono essere prescritte da qualsiasi medico abilitato e iscritto allâOrdine dei Medici, tramite prescrizione magistrale non ripetibile, ma la rimborsabilità è stabilita da ciascuna Regione e Provincia Autonoma.
Per ulteriori informazioni e normative sulla cannabis ad uso terapeutico si rimanda allâapposita sezione del sito del Ministero della Salute (11).
|
Box 1. Indicazioni allâutilizzo della cannabis terapeutica (10)
|
Diverse motivazioni hanno indotto la Fondazione GIMBE a realizzare il presente Position Statement, basato su una recente revisione sistematica della letteratura (12). Innanzitutto, il dolore cronico rappresenta lâindicazione che dal punto di vista epidemiologico ha il maggior impatto sulle necessitĂ terapeutiche e, di conseguenza, sulla produzione di cannabis: infatti, studi recenti riportano che il 45-80% dei pazienti che utilizzano prodotti a base di cannabis lo fanno per la gestione del dolore (13,14) e, tra quelli ai quali sono stati prescritti oppiodi a lunga durata dâazione per la terapia del dolore, piĂš del 39% utilizzano anche la cannabis (15,16). In secondo luogo, i medici sempre piĂš spesso dovranno discutere con i loro pazienti i potenziali benefici e rischi della cannabis visto che la decisione di prescrivere preparati a base di cannabis deve essere condivisa con il paziente, tenuto a rilasciare un consenso informato scritto. Infine, le evidenze disponibili sul trattamento del dolore cronico sono estremamente frammentate e, di conseguenza, manca una sintesi di riferimento in grado di fornire a Istituzioni, professionisti e pazienti una mappa delle prove di efficacia e dei rischi della cannabis terapeutica negli adulti con dolore cronico, finalizzata a guidare lâappropriatezza prescrittiva, le scelte dei pazienti e la necessitĂ di condurre ulteriori studi.
1. Metodi
1.1. Ricerca bibliografica
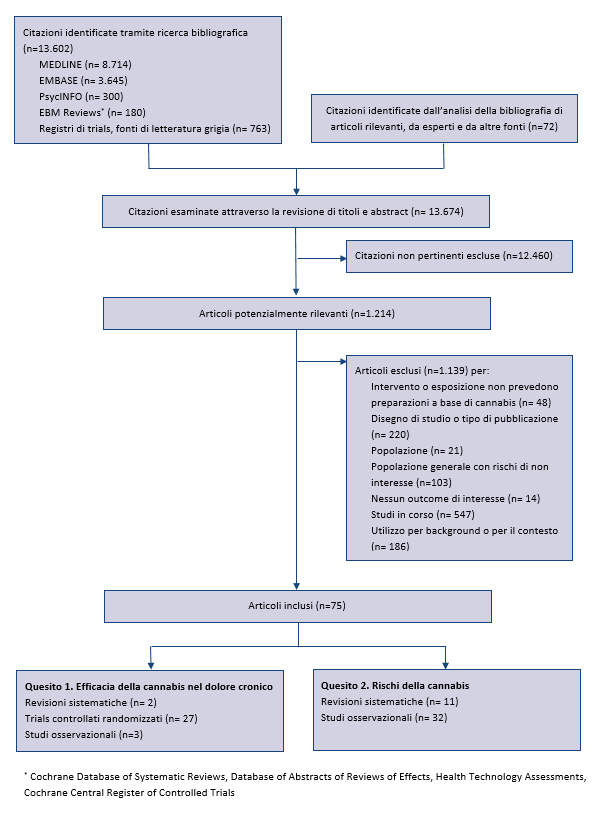
Ă stata condotta sino al marzo 2017 su numerose banche dati (MEDLINE, Embase, PubMed, PsycINFO, Evidence-Based Medicine Reviews, inclusi il Cochrane Database of Systematic Reviews, Database Abstracts of Reviews of Effectiveness, Health Technology Assessments, e il Cochrane Central Register of Controlled Trials) e fonti di letteratura grigia. Ulteriori articoli sono stati identificati tramite lâanalisi di citazioni bibliografiche e dalla consultazioni di esperti. Ă stata inoltre condotta una ricerca sui registri di trial per identificare studi in corso, o conclusi e non ancora pubblicati: Clinicaltrials.gov, International Clinical Trials Registry Platform, ISRCTN registry, National Institutes of HealthRePORTER, Agency for Healthcare Research and Quality Grants On-Line Database.
1.2. Selezione degli studi
Sono stati inclusi studi in lingua inglese che hanno valutato gli effetti dei preparati a base di cannabis naturale, intesi come qualsiasi preparazione o estratti della pianta di cannabis, in soggetti adulti escluse le donne non gravide (17,18). Per valutare lâefficacia della cannabis nel trattamento del dolore cronico, sono stati inclusi trial controllati randomizzati e studi di coorte che misuravano il dolore come outcome primario. Per la valutazione dei rischi, sono stati inclusi studi condotti sia in pazienti con dolore cronico, sia nella popolazione generale, considerato che questi ultimi potrebbero essere applicabili anche ai pazienti con dolore cronico. Inoltre, per identificare potenziali rischi la cui prevalenza non è stata ben definita in studi osservazionali di grandi dimensioni, sono stati inclusi anche studi descrittivi relativi a ârischi emergentiâ. La ricerca bibliografica era mirata ad identificare sia studi primari, sia revisioni sistematiche. Sono stati riesaminati il 5% degli abstract identificati e tutti gli articoli integrali per garantire lâaffidabilitĂ , risolvendo eventuali disaccordi con un terzo revisore. Sono stati sintetizzati i dati delle revisioni sistematiche, includendo solo quelle che descrivevano in maniera esplicita strategie di ricerca, criteri di inclusione ed esclusione degli studi e valutazione della validitĂ interna degli studi inclusi (19). Sono stati inclusi gli studi primari che soddisfacevano i criteri di inclusione, successivi alla pubblicazione delle revisioni sistematiche incluse, o da queste non presi in considerazione.
1.3. Valutazione della qualitĂ degli studi ed estrazione dei dati
Per ciascuno studio sono stati estratti i dettagli relativi a disegno, setting, popolazione, intervento, follow-up, somministrazione contemporanea di interventi rilevanti, outcome, utilizzo dellâassistenza sanitaria, effetti avversi. Due revisori indipendenti hanno valutato ciascun trial classificando il rischio di bias â risk of bias (ROB) â in basso, elevato o non chiaro utilizzando lo strumento della Cochrane Collaboration (20); i casi di disaccordo sono stati risolti tramite consenso. Per valutare il ROB degli studi osservazionali sono stati considerate le potenziali fonti di bias piĂš rilevanti adattando gli strumenti di valutazione critica (21,22).
1.4. Analisi dei dati
Per gli studi sul dolore neuropatico è stata effettuata una meta-analisi sulla percentuale di pazienti che hanno sperimentato una riduzione del dolore ≥30%. Per altri gruppi di pazienti i dati sono stati riportati in maniera qualitativa perchĂŠ varie ragioni hanno reso precluso le meta-analisi: eterogeneitĂ clinica, variazioni degli outcome riportati, limitato numero di trial. Tenendo conto della validitĂ interna dei singoli studi (23,24) e della consistenza, coerenza e applicabilitĂ delle evidenze complessive, la forza delle evidenze è stata classificata in quattro categorie (box 2).
|
Box 2. Forza delle evidenze
|
1.5. Sintesi dei dati
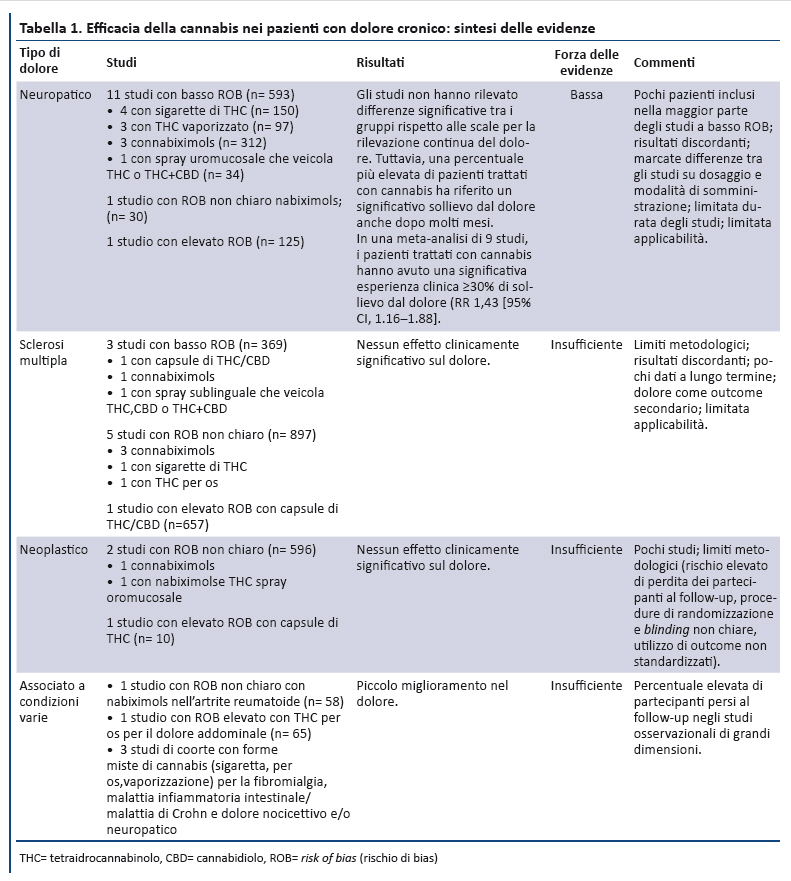
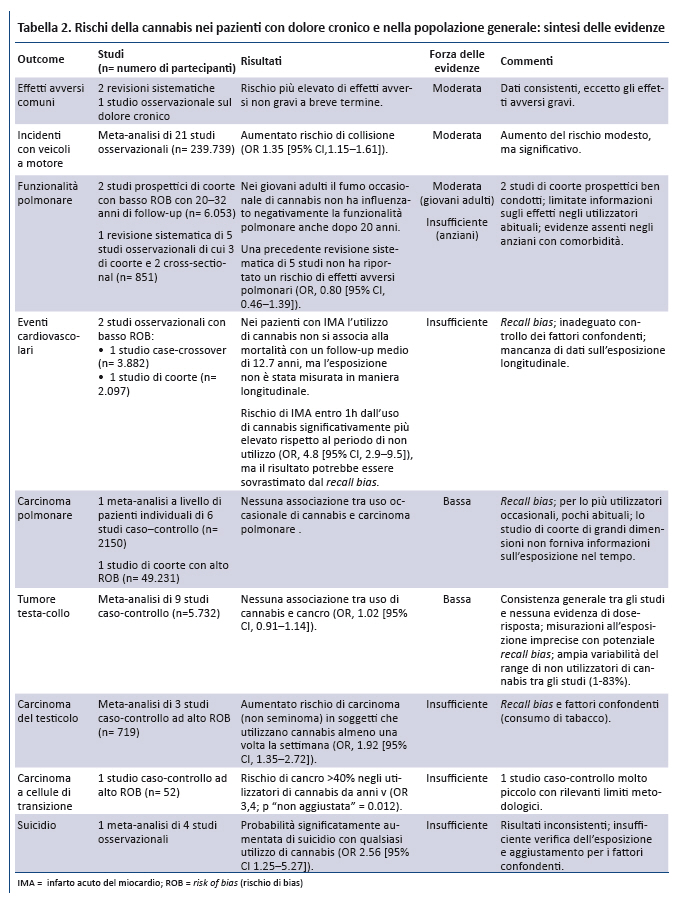
A seguito del rigoroso processo di ricerca e selezione degli studi sono stati inclusi 62 studi primari e 13 revisioni sistematiche (appendice). La sintesi delle prove di efficacia della cannabis sono riportate nella tabella 1 e il rischio di effetti avversi nella tabella 2.
2. Efficacia della cannabis nel trattamento del dolore cronico
Sono stati identificati 22 trial controllati randomizzati â randomized controlled trials (RCT) (25-46) â da 2 recenti revisioni sistematiche (17,18) e 8 ulteriori studi che soddisfacevano i criteri di inclusione: 5 RCT (47-51) e 3 studi di coorte (52-54). I metodi principali utilizzati per la valutazione continua del dolore sono la visual analogic scale (VAS) da 0 a 100 mm e la numeric rating scale (NRS) da 0 a 10 (dove 0 indica nessun dolore e 10 indica il dolore di massima intensitĂ ). Alcuni studi hanno identificato la percentuale di partecipanti che hanno sperimentato un miglioramento clinicamente significativo dellâintensitĂ del dolore, definito come una riduzione ≥30% (o approssimativamente di 2 punti) sulla NRS, oppure di 20 mm sulla VAS.
2.1. Dolore neuropatico
13 RCT hanno valutato lâefficacia dei preparati a base di cannabis sul dolore neuropatico: i partecipanti inclusi avevano un dolore neuropatico centrale o periferico correlato a varie condizioni cliniche. Il ROB di questi studi era basso per 11 (28,31,32,34,35,37,40,43,44,47,51), non chiaro in 1 (30) ed alto in 1 (39). Complessivamente, la forza delle evidenze sullâefficacia della cannabis per ridurre il dolore neuropatico era bassa. In generale, gli studi non hanno riportato differenze significative sulla rilevazione continua del dolore tra i gruppi; tuttavia, una percentuale piĂš elevata di pazienti del gruppo trattato con cannabis aveva un sollievo clinicamente significativo dal dolore per molti mesi. In 9 studi i pazienti trattati con cannabis avevano maggiore probabilitĂ di sperimentare un miglioramento del dolore ≥30% (risk ratio 1.43 [95% CI, 1.16- 1.88]). Molti studi erano di piccole dimensioni, pochi riportavano gli outcome oltre 2-3 settimane e nessuno a lungo termine. Nel trial di maggiori dimensioni, 246 pazienti con dolore neuropatico periferico hanno ricevuto nabixolmols sino ad un massimo di 24 erogazioni/die vs placebo (31). I pazienti che hanno concluso lo studio (79 nel gruppo nabixomols e 94 nel gruppo placebo) hanno avuto una significativa riduzione del dolore (odds ratio, 1.97 [CI, 1.05- 3.70]). Tuttavia, includendo tutti i partecipanti, la riduzione nello score NRS non ha raggiunto la significativitĂ statistica. Il secondo trial in ordine di dimensioni con basso ROB ha incluso 55 pazienti con infezione da HIV associata a neuropatia sensoriale, assegnati in maniera randomizzata a 3 sigarette/die con 3.56% di THC vs placebo per 5 giorni. Tra i partecipanti che hanno completato lo studio, il 52% (n = 13) del gruppo di intervento ha riportato una significativa riduzione clinica del dolore rispetto al 24% (n = 6) del gruppo placebo (37). Uno studio prospettico di coorte della durata di 1 anno (n = 431) su pazienti con dolore cronico neuropatico e nocicettivo non neoplastico ha fornito informazioni sugli effetti a lungo termine (54): gli utilizzatori di cannabis hanno avuto una riduzione dellâintensitĂ media del dolore che si è mantenuta stabile in 4 rilevazioni della VAS nellâarco di 1 anno, senza raggiungere la significativitĂ statistica (risk ratio 0.92 [CI, 0.62 -1.23]).
2.2. Sclerosi multipla
9 studi hanno esaminato lâefficacia dei preparati a base di cannabis sul dolore nei pazienti con sclerosi multipla. Nella maggior parte dei casi i partecipanti avevano dolore resistente alle terapie tradizionali o dolore neuropatico correlato a diagnosi di sclerosi multipla confermata clinicamente. Il ROB era basso per 3 studi (33,46,48), non chiaro per 5 (26,41,42,45,49) ed elevato per 1 (36). Complessivamente, la forza delle evidenze è bassa per varie ragioni: pochi studi metodologicamente rigorosi, numero limitato di pazienti inclusi, risultati incoerenti tra gli studi, mancanza di outcome a lungo termine. Dei 3 studi con basso ROB, 1 ha riportato una piccola riduzione non significativa nel ridurre il dolore a 5 settimane, 1 non ha riportato differenze negli outcome e 1 studio di grandi dimensioni ha riportato che un maggior numero di pazienti del gruppo dei pazienti trattati con cannabis riferiva sollievo dal dolore fisico a 12 settimane (28.0% vs 18.7%; P = 0.028) (33).
2.3. Dolore neoplastico
3 studi (n = 547) hanno esaminato lâefficacia dei preparati a base di cannabis sul dolore neoplastico (27, 29, 38): i partecipanti erano pazienti oncologici con dolore moderato-severo, la cui causa non era tuttavia specificata. Il ROB era non chiaro in 2 studi (27,29) ed elevato in un terzo (38). Complessivamente, le evidenze risultano insufficienti sia per il numero limitato di studi, sia per vari limiti metodologici: elevato numero di partecipanti persi al follow-up, esclusione dei pazienti con punteggi del dolore variabili, utilizzo di outcome non standardizzati, procedure di randomizzazione e di blinding non chiare.
2.4. Dolore associato a condizioni varie
2 trial (25,50) e 3 studi di coorte (52,53,54) hanno esaminato lâefficacia dei preparati a base di cannabis nei pazienti con dolore associato a condizioni varie: fibromialgia, artrite reumatoide, dolore addominale. Il ROB era non chiaro in un trial (25) ed elevato nellâaltro (50); negli studi osservazionali era basso in 1 studio (54) ed elevato in 2 (52,53). Complessivamente le evidenze erano insufficienti a causa dei risultati inconsistenti e dei limiti metodologici: assenza di follow-up, inadeguato occultamento nellâassegnazione, bias di selezione, numero elevato di partecipanti persi al follow-up, esclusione di utilizzatori occasionali di cannabis.
3. Effetti avversi associati allâutilizzo della cannabis
3.1. Pazienti con dolore cronico
2 revisioni sistematiche che hanno valutato la cannabis per il dolore cronico suggeriscono che il suo utilizzo potrebbe essere associato ad un maggior rischio di eventi avversi a breve termine (17,18). Tuttavia, la loro incidenza non presenta differenze significative tra i gruppi negli altri trial esaminati. Gli eventi avversi piĂš frequenti erano lievi (es. vertigini, senso di stordimento), mentre alcuni erano severi (es. tentativi di suicidio, paranoia, agitazione) (tabella 2). Un ulteriore studio osservazionale non ha rilevato differenze di eventi avversi gravi tra il gruppo che utilizzava la cannabis (12,5% Âą 1,5% THC, 2.5 g/d) e quello di controllo (risk ratio aggiustato 1.08 [CI, 0.57-2.04] (54).
3.2. Popolazione generale
FunzionalitĂ polmonare. Evidenze di forza moderata provenienti da 2 studi di coorte ben disegnati (55,56) suggeriscono che nei giovani adulti il fumo occasionale di cannabis non influenza negativamente la funzionalitĂ polmonare sino a 20 anni di follow-up, nonostante alcuni studi suggeriscono che lâutilizzo quotidiano per un periodo prolungato può determinare alterazioni in tal senso (57).
Eventi cardiovascolari: 2 studi (58,59) forniscono evidenze insufficienti a causa di limiti metodologici tra cui la mancata misurazione dellâesposizione in maniera longitudinale e il potenziale recall bias.
Tumori del distretto testa-collo. Una meta-analisi di 9 studi caso-controllo fornisce evidenze di forza bassa che lâuso della cannabis non si associa ad un aumentato rischio di tali neoplasie (OR 1.02 [CI, 0.91-1.14]) (60).
Carcinoma polmonare. Uno studio di coorte di grandi dimensioni (61) e una meta-analisi (62) di 6 studi caso-controllo forniscono evidenze di forza bassa che lâuso della cannabis non è associato ad un aumento del rischio di carcinoma polmonare (OR, 0.96 [CI,0.66 to 1.38]).
Carcinoma del testicolo. Per questo tumore (63) per il carcinoma a cellule di transizione (64) le evidenze sono insufficienti.
Sintomi psicotici. Da una revisione sistematica (65) e da 8 studi (66-73) emergono evidenze di forza bassa sullâassociazione tra uso di cannabis (proporzionale al contenuto in THC) e sviluppo di sintomi psicotici, sia nelle popolazioni a rischio di disturbi dello spettro psicotico sia in quelle a medio rischio. La possibilitĂ che la cannabis contribuisca direttamente allo sviluppo di tali sintomi è supportata, ma non provata, da plausibilitĂ biologica, evidenze di relazione dose-risposta, studi di coorte prospettici e studi sperimentali di piccole dimensioni.
Sintomi maniacali. Una revisione sistematica di 6 studi longitudinali fornisce evidenze di forza bassa sullâassociazione tra utilizzo di cannabis ed esacerbazioni di sintomi maniacali in pazienti con disturbo bipolare giĂ noto (74). La revisione dimostra unâelevata incidenza di sintomi maniacali di nuova insorgenza nei soggetti senza pregressa diagnosi di disturbo bipolare (OR 2.97 [CI, 1.80- 4.90]).
Funzioni cognitive. 2 revisioni sistematiche di studi condotti nella popolazione generale forniscono evidenze di forza moderata che lâutilizzo attivo di cannabis si associa a lungo termine ad effetti negativi lievi/moderati sulle funzioni cognitive, mentre nei pazienti con pregresso utilizzo di cannabis le evidenze sono insufficienti (75,76).
Suicidio. Una meta-analisi di 4 studi epidemiologici (77) ha documentato unâassociazione significativa tra lâuso di cannabis e la mortalitĂ per suicidio (OR 2.56 [CI, 1.25-5.27]) con lâuso di cannabis. Tuttavia, lâaffidabilitĂ di questo dato è condizionata da numerosi limiti: inconsistenza dei risultati negli studi inclusi, inadeguata valutazione dellâesposizione, inadeguato aggiustamento dei fattori confondenti tra gli studi.
Incidenti con veicoli a motore. Evidenze di forza moderata da una meta-analisi di 21 studi osservazionali multicentrici condotti in differenti paesi suggeriscono che lâintossicazione acuta da cannabis si associa ad un modesto aumento del rischio di incidenti (OR 1.35 [CI, 1.15 - 1.61]) (78), dopo ripetute analisi statistiche e aggiustamento delle analisi di meta-regressione.
Altri effetti avversi. Lâutilizzo a lungo termine della cannabis si associa con una grave forma di vomito ciclico, nota come sindrome da iperemesi da cannabinoidi (79-86). Gravi malattie infettive, tra cui aspergillosi (87-90) e tubercolosi, sono state associate al fumo di cannabis (91,92). Non è chiara lâevidenza degli effetti dellâuso della cannabis sul comportamento violento (93,94). In uno studio prospettico di coorte di grandi dimensioni (n = 34.653) (95), lâutilizzo della cannabis si associava a dipendenza (OR aggiustato 9.5 [CI, 6.4-14.1]). In uno studio cross-sectional di pazienti in terapia quotidiana a base di oppiodi per il dolore cronico, la prevalenza di dipendenza da cannabis era del 2.4% e il 13.2% ha riferito di aver utilizzato la cannabis negli ultimi 30 giorni (96), ma la prevalenza di dipendenza da cannabis nel sottogruppo di consumatori attivi non era riportata.
4. Discussione
Nei pazienti con dolore cronico le evidenze sui potenziali benefici e rischi della cannabis terapeutica sono limitate (tabella 1, tabella 2). In particolare, se evidenze di forza bassa dimostrano che i preparati a base di cannabis con contenuto standardizzato di THC-CBD (generalmente in rapporto 1:1 o 2:1) possono alleviare il dolore neuropatico, le evidenze sono insufficienti nei pazienti con altri tipi di dolore. La maggior parte degli studi erano di piccole dimensioni, molti hanno limiti metodologici e gli effetti a lungo termine sono poco chiari perchÊ il follow-up è limitato nella maggior parte degli studi. Inoltre, tra i diversi studi sul dolore neuropatico esistono discrepanze tra outcome continui e dicotomici; una possibile interpretazione è che la cannabis non sia efficace in maniera consistente e che, se in generale non ha effetti clinici importanti, alcuni sottogruppi di pazienti possono sperimentare benefici rilevanti. Purtroppo, non si conoscono i sottogruppi di pazienti che possono beneficiarne con maggiore o minore probabilità . Questi risultati sono in linea con la recente revisione sistematica della National Academies of Sciences, Engineering and Medicine (97) che, esaminando gli effetti della cannabis su un ampio range di outcome, conclude che esistono prove di efficacia della cannabis nei pazienti con dolore cronico, di forza moderata e limitate al dolore neuropatico, e rileva la necessità di ulteriori studi.
Evidenze di forza moderata documentano che il fumo occasionale di cannabis non pregiudica la funzione polmonare anche dopo circa 20 anni. Tuttavia, i dati limitati sugli effetti nei fumatori abituali di cannabis suggeriscono un possibile deterioramento della funzione polmonare a lungo termine (55,56). Evidenze di forza bassa documentano che lâuso di cannabis occasionale/moderato non è associato a diagnosi di cancro polmonare o di cancro testa-collo indipendentemente dallâutilizzo di tabacco, ma i dati sono limitati perchè gli studi caso-controllo non arruolavano consumatori abituali. Le evidenze sullâassociazione tra uso di cannabis ed eventi cardiovascolari a lungo termine sono di forza bassa.
Lâutilizzo di cannabis ha potenziali gravi effetti sulla salute mentale e si associa a eventi avversi di tipo cognitivo, sebbene le evidenze siano insufficienti a definire lâentitĂ del rischio o identificare i soggetti a rischio piĂš elevato. Lâuso di cannabis sembra comunque associato a lievi effetti avversi di tipo cognitivo negli utilizzatori attivi, ma gli effetti a lungo termine negli ex-utilizzatori sono incerti. Esiste unâassociazione consistente tra uso di cannabis e sviluppo di sintomi psicotici sia a breve sia a lungo termine. Un grande studio prospettico di coorte ha rilevato che lâuso di cannabis si associa a un rischio sostanziale di dipendenza da cannabis e un rischio seppure inferiore di dipendenza da alcool e da altre sostanze (95). Infine, è importante conoscere alcuni eventi avversi verosimilmente correlati allâutilizzo di cannabis (es. complicanze infettive, sindrome da iperemesi da cannabis, comportamento violento), anche se la loro incidenza non è nota.
La terapia non farmacologica e quella farmacologica non a base di oppioidi rappresentano i trattamenti di prima scelta per il dolore cronico (98). I medici possono utilizzare la cannabis per il trattamento del dolore cronico nei pazienti che non hanno risposto a questi trattamenti (99). Tuttavia, nessuno studio ha direttamente comparato la cannabis con gli oppiodi e non esistono evidenze se lâutilizzo di cannabis influenzi lâuso degli oppioidi e gli effetti avversi oppiodo-correlati. Studi cross-sectional suggeriscono unâassociazione tra utilizzo di cannabis ed eventi avversi correlati agli oppiodi, ovvero abuso o maggiore utilizzo (15,16,100-102). Di contro, uno studio open label ha rilevato che gli score del dolore e lâutilizzo di oppiodi diminuivano per oltre 6 mesi nei pazienti con dolore cronico che avevano iniziato il trattamento con la cannabis, anche se lâaffidabilitĂ di questi risultati è limitata dal numero elevato di partecipanti persi al follow-up (103).
5. Limiti
LâapplicabilitĂ dei risultati di questa revisione alla pratica clinica presenta alcuni limiti. Innanzitutto, le popolazioni di pazienti in molti studi erano estremamente selezionate e alcuni hanno previsto un periodo di run-in dopo il quale i non responders venivano esclusi dallâanalisi. In secondo luogo, i dati sullâefficacia provengono soprattutto da studi che utilizzano formulazioni con contenuti di THC e CBD che potrebbero differire da quelli della cannabis FM2 e da preparazioni non autorizzate (104).
Le evidenze sui rischi sono limitate perchĂŠ gli studi includono pochi pazienti anziani, malati cronici e quelli con storia importante o prolungata di utilizzo di cannabis. Inoltre, i rischi sono stati valutati sia nei pazienti con dolore cronico sia nella popolazione generale, anche se rimane incerto il grado di applicabilitĂ dei dati sul rischio della popolazione generale ai pazienti con dolore cronico. Infine, negli studi osservazionali, la dose esatta di esposizione alla cannabis era raramente nota a causa del recall bias e la potenza (ovvero la stima di sigarette con cannabis fumate al giorno) era impossibile da valutare.
6. Conclusioni
A fronte di un incremento della disponibilitĂ di cannabis per uso terapeutico e alle grandi aspettative dei pazienti, solo pochi studi rigorosi ne hanno valutato lâefficacia sul dolore cronico: in particolare, limitate evidenze suggeriscono che la cannabis può alleviare il dolore neuropatico, ma su altri tipi di dolore le prove di efficacia sono insufficienti. Relativamente ai rischi, dalla revisione emergono limitate evidenze sullâassociazione tra il consumo di cannabis e lâaumento del rischio di eventi avversi non gravi a breve termine e di gravi effetti avversi sulla salute mentale, come le psicosi.
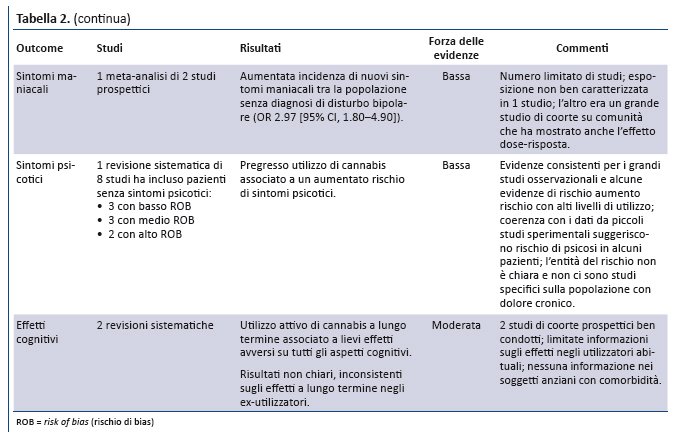
Considerato che nei pazienti con dolore cronico non esistono dati definitivi sui benefici della cannabis e sono disponibili limitate informazioni sui rischi, è indispensabile la conduzione di studi metodologicamente rigorosi e di adeguate dimensioni per rispondere ai quesiti di ricerca non ancora risolti (tabella 3).
Affiliazione degli Autori
Antonino Cartabellotta, Medico Chirurgo, Fondazione GIMBE
Corrado Iacono, Farmacista, Dipartimento Farmaceutico AUSL di Bologna
Contributo degli Autori
-Disclosure dei conflitti di interesse
Nessuno dichiaratoIndirizzo per la corrispondenza
nino.cartabellotta@gimbe.orgProvenienza
Non commissionato, non sottoposto a peer-reviewFonti di finanziamento
NessunaApprovazione comitato etico
-Ringraziamenti
-Pagina aggiornata il 28/novembre/2017



