Guidelines & Standards
Evidence 2016;8(7): e1000147 doi: 10.4470/E1000147
Pubblicato: 29 luglio 2016
Copyright: © 2013 Gagnier et al. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Background. Un case report è la descrizione narrativa di un caso clinico per scopi clinici, scientifici o formativi. Considerata l’assenza di specifiche linee guida per il reporting, i case report mancano del rigore necessario per guidare la pratica professionale o informare il disegno di studi clinici.
Obiettivo. Sviluppare, disseminare e implementare linee guida per il reporting dei casi clinici.
Metodi. è stato utilizzato un processo di consenso in 3 step: 1) pre-meeting: revisione della letteratura e interviste per definire gli item da includere nelle linee guida per il reporting; 2) meeting di consenso: stesura della bozza delle linee guida per il reporting; 3) post-meeting: feedback, revisione della bozza, test pilota e stesura della versione finale delle linee guida per il reporting.
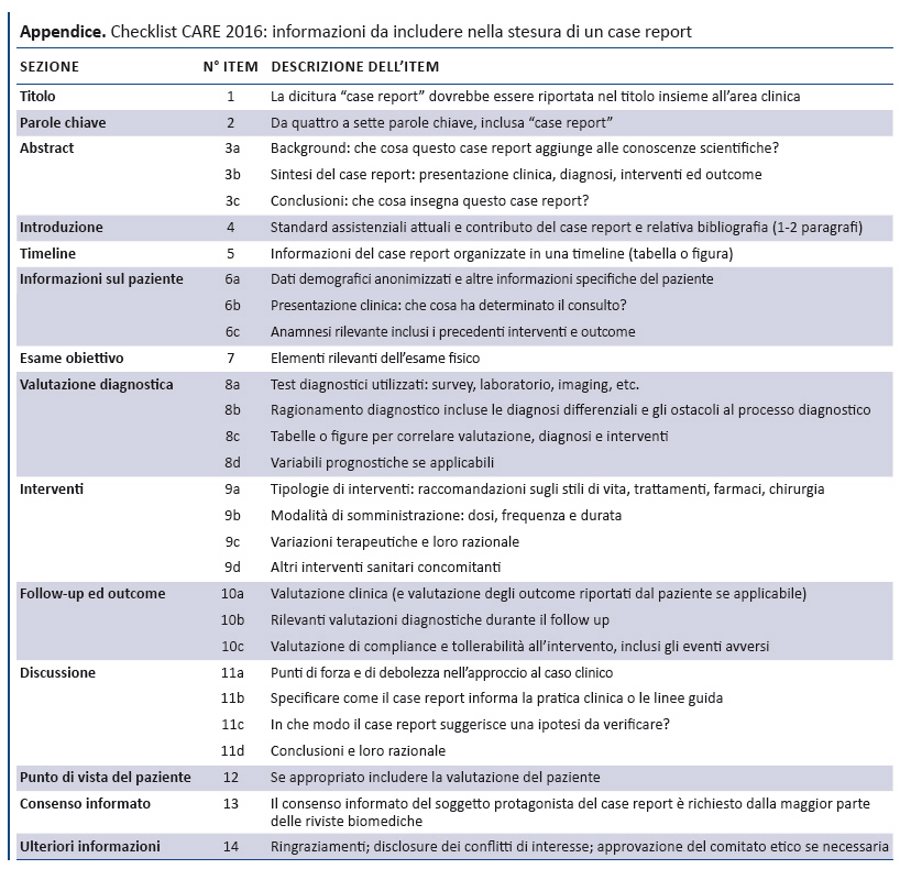
Risultati. Il processo di consenso, che ha coinvolto 27 partecipanti, ha portato alla stesura di una checklist di 13 item per il reporting dei casi clinici. Gli item principali di questa checklist sono: titolo, parole chiave, abstract, introduzione, informazioni sul paziente, dati clinici, timeline, valutazione diagnostica, interventi terapeutici, follow-up e outcome, discussione, punto di vista del paziente e consenso informato.
Conclusioni. Auspichiamo che l’implementazione delle linee guida CARE (CAse REport) da parte delle riviste biomediche migliorerà completezza e trasparenza dei case report pubblicati, permettendone una aggregazione sistematica che potrà informare il disegno di studi clinici, fornire tempestive informazioni su efficacia ed effetti avversi e migliorare l’assistenza sanitaria.
1. Introduzione
I case report (CR) descrivono casi clinici osservati generalmente in setting clinico-assistenziali e sono particolarmente utili per accertare efficacia e rischi dei trattamenti, identificare nuove malattie, riconoscere presentazioni cliniche di malattie rare o presentazioni insolite di malattie comuni (1). Ad esempio, il rapporto causale tra talidomide e malformazioni congenite (2) e l’efficacia del propranololo per trattare l’emangioma infantile sono stati riconosciuti grazie ai CR (3). I CR possono generare ipotesi per studi futuri, guidare la personalizzazione dei trattamenti (4,5) e permettono di attuare l’apprendimento basato su problemi clinici (problem-based learning).
Sempre più frequentemente i CR vengono pubblicati su riviste biomediche (6), anche se la loro qualità è molto variabile (7,8). Ad esempio, esaminando 1.316 CR pubblicati da quattro riviste peer review di medicina d’urgenza, uno studio ha dimostrato che oltre la metà non forniva informazioni sul trattamento principale, limitando trasparenza e riproducibilità dei CR (9). Inoltre, in assenza di linee guida per il reporting, i CR spesso non sono sufficientemente rigorosi da permettere di aggregare e analizzare i dati, per guidare la pratica clinica o informare il disegno di studi clinici (9).
Oggi sono disponibili linee guida per il reporting di diversi disegni di studio: trial controllati randomizzati (Consolidated Standards of Reporting Trial: CONSORT) (10), studi osservazionali (Strengthening the Reporting of Observational studies in Epidemiology: STROBE) (11), revisioni sistematiche e meta-analisi (Preferred Reporting Items for Systematic Reviews and Meta-Analyses: PRISMA) (12). Evidenze empiriche suggeriscono che l’integrazione del CONSORT Statement nelle istruzioni per gli autori delle riviste biomediche si associa a un reporting più completo dei trial randomizzati pubblicati (13). Considerato che attualmente esistono solo linee guida per CR di eventi avversi (14), obiettivo del presente lavoro è sviluppare linee guida per il reporting di CR attraverso un processo di consenso formale.
2. Metodi
2.1 Disegno. Seguendo la Guidance for Developers of Health Research Reporting Guidelines (15) è stato sviluppato un processo di consenso in tre step (16): 1) pre-meeting: revisione della letteratura e interviste per definire gli item da includere nella checklist; 2) meeting di consenso per la stesura delle linea guida per il reporting; 3) post-meeting: feedback, revisione della bozza, test pilota e stesura della versione finale delle linee guida per il reporting dei CR.
2.2 Partecipanti. Sono stati contattate 28 persone con almeno uno dei seguenti requisiti (17-19): 1) pubblicazione di articoli correlati a CR; 2) pubblicazione di manuali, handbook o linee guida metodologiche sui CR; 3) pubblicazione di revisioni sistematiche su metodi o reporting dei CR; 4) pubblicazione di altre linee guida per il reporting della ricerca clinica.
2.3 Il processo di consenso
Step 1. Il comitato di indirizzo costituito da 4 autori (JJG, GK, DM e DR), ha effettuato una ricerca bibliografica sul ruolo dei CR, raccomandazioni per la loro pubblicazione e survey sulla valutazione della loro qualità . Successivamente è stata inviata ai 28 potenziali partecipanti una lettera con l’obiettivo del meeting, i dettagli sulle tecniche di consenso e la richiesta di partecipazione allo sviluppo di specifiche raccomandazioni per il reporting dei CR. Le 27 persone che hanno accettato l’invito hanno ricevuto una selezione di articoli chiave sui CR e sono stati intervistati telefonicamente su: 1) informazioni da inserire nelle linee guida per il reporting dei CR; 2) razionale dei loro suggerimenti; 3) bibliografia di supporto. Tre autori (JJG, GK e DR) hanno raggruppato per tematica le raccomandazioni della letteratura e le interviste insieme a razionale, bibliografia e definizioni operative, senza assegnare score quantitativi.
Step 2. Al meeting di consenso organizzato presso la University of Michigan (Ann Arbor, 16-18 ottobre 2012) erano presenti 18 dei partecipanti allo step 1, oltre ad un assistente di ricerca e 2 studenti in qualità di osservatori. Nella fase iniziale del meeting è stata effettuata, prima in piccoli gruppi e poi in sessione plenaria, una revisione in cieco delle raccomandazioni ottenute dalle interviste nello step 1. Il giorno successivo, la discussione su ogni potenziale item è continuata in plenaria, permettendo di esprimere chiarimenti, opinioni, giustificazioni, definizioni operative e nuove idee. Al termine della seconda giornata il gruppo ha concordato un set preliminare di item per il reporting.
Step 3. La bozza della checklist, perfezionata dal comitato di indirizzo, è stata inviata per due round di revisioni all’intero gruppo (partecipanti alle fasi 1 e 2). Nella versione finale delle linee guida per il reporting dei CR sono inclusi i feedback dell’intero gruppo CARE (CAse REport).
3. Risultati
Al fine di indentificare le informazioni utili, la struttura della checklist CARE corrisponde alle componenti principali di un case report. La checklist è preceduta da uno statement che descrive come riportare un caso clinico in forma narrativa. Dopo il meeting il gruppo CARE ha suggerito che lo stile narrativo di un CR dovrebbe essere coerente in tutte le sezioni, compreso il razionale per ciascuna conclusione e i messaggi chiave.
È raccomandato l’uso di una timeline (item 7) in forma di tabella o figura per riportare le date specifiche e le tempistiche rilevanti degli elementi del caso clinico: anamnesi familiare e patologica remota, informazioni genetiche, sintomi attuali, risultati dei test diagnostici, interventi e ogni eventuale evento insorto durante il follow-up. La timeline dovrebbe mostrare la sequenza temporale degli eventi più rilevanti.
La checklist prevede item diversi per le valutazioni diagnostiche (item 8) e gli interventi terapeutici (item 9), riconoscendo che entrambi sono spesso rilevanti nella descrizione di un caso clinico.
Il gruppo ha discusso a lungo se includere il punto di vista del paziente relativo alla propria esperienza di malattia: alla fine si è deciso di inserire gli outcome riferiti dal paziente e, quando possibile, le sue esperienze (item 12). Si è discusso, inoltre, sulla necessità di linee guida per gli outcome riferiti dal paziente, visto che il CONSORT ha recentemente pubblicato il CONSORT-PRO, estensione sugli outcome riferiti dal paziente nei trial randomizzati (20).
Infine, è stato inserito l’item 13 sul consenso informato, perché gli autori hanno il dovere etico di ottenerlo dal paziente prima di pubblicare in un CR informazioni che lo riguardano. In particolare, il consenso è realmente informato quando il paziente o un suo familiare legge il CR e ne approva i contenuti. Se il paziente non è in grado di dare il consenso e non è possibile reperire un familiare, gli autori dovrebbero richiedere l’autorizzazione alla pubblicazione a un comitato etico. La tabella riporta la checklist CARE.

4. Discussione
La checklist CARE è costituita da 13 item essenziali che gli autori devono prendere in considerazione quando sottomettono un CR per la pubblicazione, al fine di migliorarne completezza e trasparenza. Si è cercato di raggiungere un equilibrio tra livello di dettaglio e linguaggio conciso, una delle principali caratteristiche di un CR.
Se da sempre i CR rappresentano una fonte rilevante di nuove idee e informazioni in medicina (21), oggi iniziano ad assumere rilevanza per valutare l’efficacia dei trattamenti nel paziente individuale. BioMed Central ha lanciato nel 2007 il Journal of Medical Case Report (22) e nel 2012 il BioMed Central Case Report Database che contiene oltre 11.000 CR pubblicati da 50 riviste biomediche. In 6 mesi sono stati pubblicati oltre 26.000 CR su 212 riviste medico-scientifiche (23).
La checklist CARE ha l’obiettivo di migliorare il reporting dei CR, visto che consistenti evidenze dimostrano che le linee guida per il reporting migliorano la completezza dei contenuti scientifici pubblicati (13,24,25). Una recente revisione Cochrane, includendo 53 studi che valutavano 16.604 trial controllati randomizzati, ha analizzato gli effetti dell’aderenza al CONSORT Statement da parte delle riviste biomediche. Anche se l’impatto potenziale del CONSORT e delle sue estensioni non è stato pienamente raggiunto le riviste aderenti hanno complessivamente migliorato il reporting dei trial controllati randomizzati. Uno studio sulle istruzioni per i revisori di 116 riviste biomediche ha osservato che soltanto 41 (35%) fornivano istruzioni online; di queste, solo 19 (46%) facevano riferimento a linee guida per il reporting (26). Gli autori, dal canto loro, forniscono alcune raccomandazioni agli editori per migliorare il processo di peer review dei manoscritti sottolineando la responsabilità delle stesse riviste nel supportare i revisori (26).
Gli autori delle linee guida per il reporting hanno la responsabilità di pianificare una strategia di disseminazione e implementazione per sostenere il loro utilizzo (15). Le nostre iniziative prevedono:
1. Presentazione delle linee guida CARE a conferenze e workshop, tra cui il Peer Review and Biomedical Publication Congress (Chicago, 10 Settembre 2013).
2. Contemporanea pubblicazione di questo articolo in numerose riviste biomediche, sino a raggiungere le 212 che hanno inserito CR nel BioMed Central Case Report Database.
3. Pubblicazione di un articolo di spiegazione ed elaborazione, per fornire il razionale di ciascun item e includere evidenze empiriche ed esempi di adeguate modalità di reporting selezionate da CR pubblicati.
4. Test pilota i cui risultati preliminari supportano le linee guida CARE così come sono state elaborate e presentate (comunicazione personale di Helmut Kiene, Erika Oberg, Bill Manahan). Le estensioni delle linee guida CARE per le varie specialità sono in via di sviluppo.
5. Disponibilità delle linee guida CARE e dei documenti correlati su un sito web dedicato (www.CAREstatement.org) e sul sito web dell’EQUATOR Network (www.equator-network.org) e relative traduzioni in diverse lingue.
6. Promozione della checklist CARE da parte di autori, editori di riviste biomediche, revisori e dell’intera comunità medico-scientifica e invio di feedback che potrebbero essere inclusi negli aggiornamenti periodici delle linee guida CARE.
7. Promozione e supporto di studi per valutare l’impatto delle linee guida CARE sulla stesura di CR.
5. Limiti
Le linee guida CARE e il loro processo di sviluppo presentano alcuni potenziali limiti. Innanzitutto, sono state elaborate attraverso un metodo di consenso e dunque rappresentano l’opinione degli autori: tuttavia il consenso è stato facilmente raggiunto durante il meeting, si è fatto riferimento ad evidenze empiriche se disponibili e numerosi soggetti non coinvolti nel meeting di consenso hanno fornito il proprio feedback. In secondo luogo, riconosciamo che la relazione causa-effetto rappresenta un limite dei CR, anche quando vengono seguite le linee guida per il reporting (27,28). Le linee guida CARE enfatizzano la qualità delle informazioni indipendentemente dalle relazioni causa-effetto. Professionisti di differenti specialità , medici o pazienti richiederanno probabilmente estensioni delle linee guida CARE con le informazioni sulle singole specialità /discipline. Invitiamo alla discussione i gruppi interessati all’uso delle linee guida CARE come base per le loro specifiche necessità di reporting. Infine, le riviste biomediche richiedono spesso agli autori di gestire tre aspetti non citati dalle linee guida CARE: potenziali conflitti di interesse, anonimizzazione dai dati sensibili del paziente ed eventuale approvazione del comitato etico se ottenuta o necessaria.
6. Conclusioni
Prevedendo una progressiva rilevanza dei CR, abbiamo elaborato linee guida per il reporting destinate a tutti i professionisti sanitari. L’incremento dei CR pubblicati, in un periodo in cui trial clinici e revisioni sistematiche dominano gli indici delle riviste biomediche, testimonia il valore dei CR e in particolare l’importanza crescente delle terapie personalizzate. A differenza dei trial clinici randomizzati controllati, i CR sono articoli scientifici relativi a un singolo paziente, dove la numerosità del campione si attesta sempre sull’unità . Se raccolti con modalità sistematiche e associati in dataset più ampi, i CR possono essere analizzati incrementando la loro capacità di identificare precocemente rischi e benefici degli interventi sanitari.
Prevediamo che l’analisi di informazioni aggregate in maniera sistematica su casi clinici potrà fornire conoscenze applicabili sull’efficacia dei trattamenti per il paziente individuale guidate dai dati clinici, facilitando il confronto tra differenti culture e sistemi sanitari. I medici saranno ben presto in grado di fornire ai pazienti, e talvolta sarà loro esplicitamente richiesto, informazioni dai loro casi clinici. Questo produrrà un cambiamento sulle nostre modalità di percezione delle evidenze e ne rivoluzionerà la loro produzione, diffusione e utilizzo aprendo nuovi scenari. Quando saranno chiare le modalità con cui i nuovi dati potranno contribuire alla creazione di evidenze, gli sforzi attuali per produrre dati di elevata qualità saranno premiati e saremmo più inclini ad osservare e descrivere casi clinici. Le linee guida CARE offrono un framework in grado di aumentare precisione, completezza e trasparenza dei CR.
IL GRUPPO CARE
1. Alyshia Allaire, BA, Portland, OR, USA
2. Douglas G. Altman, DSc, Center for Statistics in Medicine, University of Oxford, Oxford, UK
3. Jeffrey Aronson, MB, ChB, MA Dphil, FRCP, FB, PharmacolS, University of Oxford, Oxford, UK*
4. James Carpenter, MD, Department of Orthopedic Surgery, University of Michigan, Ann Arbor, MI, USA
5. Joel Gagnier, ND, MSc, PhD, Departments of Orthopedic Surgery and Epidemiology, University of Michigan, Ann Arbor, MI, USA
6. Patrick Hanaway, MD, Director of Medical Education, Institute for Functional Medicine, Asheville, NC, USA*
7. Carolyn Hayes, PhD, RN, NEA-BC, Dana-Farber Brigham and Women’s Cancer Center, Boston, MA, USA
8. David Jones, MD, President, Institute for Functional Medicine, Ashland, OR, USA
9. Marietta Kaszkin-Bettag, PhD, University of Frankfurt, Pharmalex GmbH, Mannheim, Germany
10. Michael Kidd, AM, MD, Editor-in-Chief Journal of Medical Case Reports, Faculty of Health Sciences, Flinders University, Adelaide, Australia*
11. Helmut Kiene, Dr med, Editor, Global Advances in Health and Medicine, Institute for Applied Epistemology and Research Methodology, University of Witten/Herdecke, Freiburg, Germany
12. Gunver Kienle, Dr med, Editor, Global Advances in Health and Medicine, Institute for Applied Epistemology and Research Methodology, University of Witten/Herdecke, Freiburg, Germany
13. Ben Kligler, MD, MPH, Co-Editor-in-Chief Explore, Beth Israel Medicine Center, New York, NY, USA*
14. Lori Knutson, RN, BSN, HN-BC, Integrative Healthcare Solutions, Minneapolis, MN, USA
15. Christian Koch, MD, PhD, FACP, FACE, Deputy Editor Journal of Medical Case Reports, University of Mississippi, Jackson, MS, USA*
16. Karen Milgate, MPP, Independent Health Policy Consultant, Washington, DC, USA*
17. Michele Mittelman, RN, MPH, Editor, Global Advances in Health and Medicine, Dover, MA, USA
18. David Moher, PhD, Ottawa Hospital Research Institute; Department of Epidemiology and Community Medicine, University of Ottawa, Ottawa, Ontario Canada*
19. Hanna Oltean, MPH, University of Michigan, Ann Arbor, MI, USA
20. Greg Plotnikoff, MD, MTS, FACP, Editor, Global Advances in Health and Medicine, Allina Center for Healthcare Innovations and the Penny George Institute for Health and Healing, Minneapolis, MN, USA
21. Richard Alan Rison, MD, FAANEM, Deputy Editor, Journal of Medical Case Reports, Section Editor, BMC Research Notes, PIH Health Hospital, Whittier, University of Southern California, Los Angeles, CA, USA*
22. David Riley MD, Editor-in-Chief, Global Advances in Health and Medicine, Portland, OR, USA
23. Anil Sethi, MS, Johns Hopkins School of Medicine -
Information architecture and IT, Palo Alto, CA, USA*
24. Larissa Shamseer, MSc, Ottawa Hospital Research Institute, Ottawa, Ontario, Canada
25. Richard Smith, MB, ChB, MSc, United Healthcare Chronic Disease Initiative, London, UK
26. Harold Sox, MD, The Dartmouth Institute, Hannover, NH, USA
27. Peter Tugwell, MD, FRCP, University of Ottawa, Ottawa, Ontario, Canada
*Hanno partecipato al processo di sviluppo, revisione e stesura delle linee guida CARE, ma non hanno partecipato al meeting di consenso.
Contributo degli Autori
Joel J. Gagnier, Gunver Kienle, Douglas G. Altman, David Moher, Harold Sox, David Riley soddisfano i criteri ICMJE per l’authorship.
Stesura del manoscritto: Joel J. Gagnier, David Riley.
Revisione critica di importanti contributi intellettuali: Douglas G. Altman, Joel J. Gagnier, Gunver Kienle, David Moher, David Riley, Harold Sox.
L’intero gruppo CARE ha partecipato, in parte o globalmente, al processo di sviluppo delle linee guida CARE e ha contribuito alla loro redazione e revisione, oltre che a quella del presente articolo.
Disclosure dei conflitti di interesse
Nessuno dichiarato.Indirizzo per la corrispondenza
driley@gahmllc.comProvenienza
Tradotto da: Gagnier JJ, Kienle G, Altman DG, Moher D, Sox H, Riley D; CARE Group. The CARE guidelines: consensus-based clinical case reporting guideline development. J Med Case Rep 2013;7:223.Fonti di finanziamento
Il progetto è stato finanziato da: Dipartimento di Chirurgia Ortopedica, Ufficio di Vicepresidenza della Ricerca della University of Michigan e Global Advances in Health and Medicine. D.M. è finanziato da una cattedra di ricerca della University of Ottawa. I fondi sono stati utilizzati per rimborsare le spese di viaggio dei partecipanti alla conferenza. Non sono stati previsti onorari. Lo steering committee era composto da J.J.G., G.K., D.M. e D.R. su base volontaria.Approvazione comitato etico
-Ringraziamenti
Joel J. Gagnier (University of Michigan) e David Riley (Global Advances in Health and Medicine) hanno coordinato questo progetto di sviluppo di linee guida basato sul consenso.
Note alla versione italiana
La Fondazione GIMBE ha realizzato la traduzione italiana dell’articolo senza alcun finanziamento istituzionale o commerciale.
Alla data di pubblicazione del presente articolo sul sito CARE (www.care-statement.org) è disponibile una versione della checklist aggiornata a gennaio 2016, la cui traduzione italiana è disponibile in appendice.
Team che ha realizzato la versione italiana
Responsabile scientifico
Antonino Cartabellotta, Fondazione GIMBE
Coordinamento editoriale
Marco Mosti, Fondazione GIMBE
Traduzione
Alfredo Potena, UO Pneumologia e Medicina Interna, Clinica Salus-Saninvest, Ferrara
Revisione editoriale
Elena Cottafava, Fondazione GIMBE
Roberto Luceri, Fondazione GIMBE



