Guidelines & Standards
Evidence 2016;8(5): e1000142 doi: 10.4470/E1000142
Pubblicato: 27 maggio 2016
Copyright: © 2016 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Secondo stime relative al 2010, le spese globali per la ricerca scientifica ammontano ad oltre 240 miliardi di dollari: se questi investimenti hanno indubbiamente determinato rilevanti miglioramenti di salute delle popolazioni, ulteriori traguardi potrebbero essere raggiunti eliminando sprechi e inefficienze nei processi con cui la ricerca viene commissionata, pianificata, condotta, analizzata, normata, gestita, disseminata e pubblicata. Oggi, infatti, la ricerca biomedica è afflitta da un fenomeno imbarazzante e sempre più diffuso: numerose scoperte inizialmente promettenti non determinano alcun miglioramento nell’assistenza sanitaria perché molti studi non riescono a concretizzare robuste evidenze da integrare nelle decisioni che riguardano la salute delle persone (1).
Il quadro sopra descritto consegue a un complesso sistema di azioni e relazioni tra diversi attori della ricerca, ciascuno dei quali agisce in sistemi che presentano rischi e fattori incentivanti. Le azioni risultano dall’interazione tra capacità (intellettive e fisiche del singolo di affrontare azioni specifiche), opportunità (fattori esterni all’individuo che rendono possibili le azioni) e motivazioni (driver che motivano e guidano i comportamenti).
Nel 1994 Douglas Altman nello storico editoriale The Scandal of Poor Medical Research denunciava la scarsa qualità nel disegno e nel reporting della ricerca, affermando che “ogni anno ingenti somme di denaro vengono investite per condurre ricerca gravemente viziata da disegni di studio inappropriati, campioni piccoli e non rappresentativi, metodi di analisi inadeguati e interpretazioni distorte” (2). Da allora le problematiche si sono moltiplicate e si sono accumulate consistenti evidenze del loro impatto, facendo emergere ulteriori preoccupazioni sulla scarsa qualità della ricerca.
Nel 2009 Chalmers et Glasziou identificavano le principali fonti di sprechi evitabili nella ricerca biomedica: quesiti di ricerca irrilevanti, qualità metodologica inadeguata, inaccessibilità dei risultati, studi distorti da reporting selettivi e altri tipi di bias (3). Senza considerare le inefficienze delle fasi di regolamentazione e gestione della ricerca gli sprechi ammonterebbero all’85% degli investimenti, un impatto talmente elevato che la discussione innescata da quell’articolo ha generato numerosi eventi finalizzati a esplorare strumenti e strategie per affrontare una situazione non più accettabile.
Nel 2012 la consapevolezza di questi fenomeni è stata accelerata dalla pubblicazione di Bad Pharma, saggio di Ben Goldacre che ha definito con estrema chiarezza le conseguenze per la salute pubblica che emergono dalla mancata pubblicazione o dal reporting selettivo degli outcome nella ricerca sponsorizzata dall’industria del farmaco (4). Questi problemi sono stati documentati per la maggior parte di aree della ricerca: farmacologica e non, di base e applicata, osservazionale e sperimentale, sugli uomini e sugli animali.
Nel 2013 una maggiore consapevolezza su questi temi ha favorito il lancio della campagna AllTrials (5), che chiede di registrare tutti i trial clinici e di pubblicarne tutti i risultati (6).
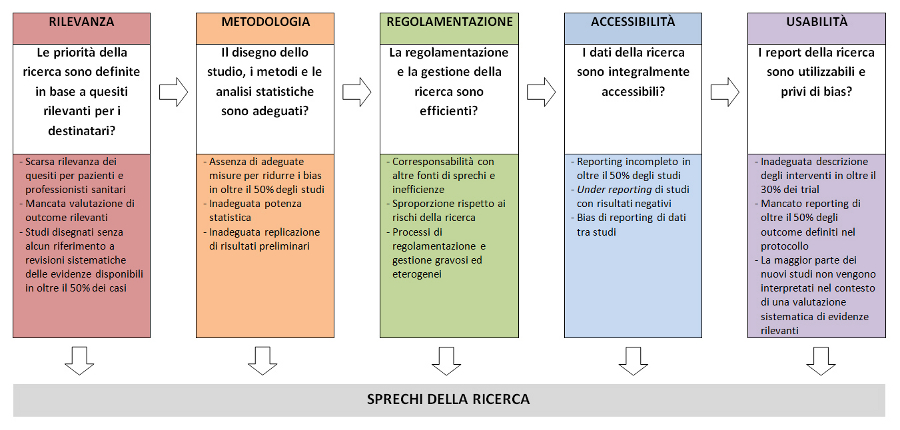
Nel gennaio 2014 The Lancet ha pubblicato la serie Research: Increasing Value, Reducing Waste (7) documentando che per aumentare il ritorno degli investimenti della ricerca (value) è necessario stabilire prioritĂ piĂą rilevanti (8), migliorare disegno, conduzione e analisi (9), ottimizzare le procedure di gestione e regolamentazione (10), garantire un adeguato reporting (11) e una migliore usabilitĂ della ricerca (12). È stata quindi costituita la REWARD (REduce research Waste And Reward Diligence) Alliance (13) e lanciata la campagna Lancet-REWARD (14) che ha pubblicato il REWARD Statement (box) e le raccomandazioni con relativi indicatori di monitoraggio su cinque aree di potenziali sprechi della ricerca biomedica (figura): rilevanza della ricerca, adeguatezza del disegno dello studio, dei metodi e delle analisi statistiche, efficienza dei processi di regolamentazione e gestione, completa accessibilitĂ ai dati, usabilitĂ dei report.
|
Box. REWARD Statement Siamo consapevoli che, nonostante i nostri sforzi per eccellere nella ricerca, ampi sono i margini di miglioramento per ridurre gli sprechi e aumentare il value dei nostri contributi. Il potenziale dei nostri studi viene massimizzato quando:
Crediamo che sia nostra responsabilitĂ contribuire non solo al progresso delle conoscenze, ma anche al progresso della metodologia della ricerca. Questo permetterĂ di migliorare la salute e la vita delle persone in tutto il mondo. In qualitĂ di finanziatori, enti regolatori, organizzazioni commerciali, editori, direttori di riviste biomediche, ricercatori, utilizzatori della ricerca e altro ci impegniamo a fare la nostra parte per aumentare il value e ridurre gli sprechi della ricerca. Per adesioni istituzionali alla campagna Lancet-REWARD contattare Tamara Lucas (tamara.lucas@lancet.com), inviando il logo dell’organizzazione che verrĂ inserito nella pagina web. È possibile fornire contenuti per il sito web, in particolare esempi di misure che la propria organizzazione ha intrapreso o intende intraprendere per aumentare il value e ridurre gli sprechi della ricerca. |
Nel settembre 2015, in occasione della prima conferenza Lancet-REWARD, è stato pubblicato un primo report sugli outcome della campagna che, oltre a dare vita ad un acceso dibattito, ha generato numerose iniziative ed è sull’agenda di rilevanti categorie di stakeholders: finanziatori, agenzie regolatorie, riviste biomediche, istituzioni di ricerca e ricercatori (15).
Considerato che ciascuno degli stakeholders della ricerca agisce per il proprio interesse, aumentando gli sprechi e riducendo il value della ricerca biomedica, la campagna Lancet-REWARD intende dare nuovo vigore al processo scientifico promuovendo nuovi sistemi di supervisione e regolamentazione finalizzati a incentivare il rigore metodologico, a proteggere l’integrità del processo scientifico e ad allontanare i ricercatori da indebite influenze.
Solo assicurando rigore in tutte le fasi della ricerca la comunitĂ scientifica sarĂ in grado di proteggere se stessa dai sofismi della politica, separare le conflittuali logiche capitalistiche da quelle della scienza e dare reale valore al denaro dei finanziatori liberali e dei contribuenti, aumentando il value e riducendo gli sprechi della ricerca (16).
RACCOMANDAZIONI REWARD E CRITERI DI MONITORAGGIO
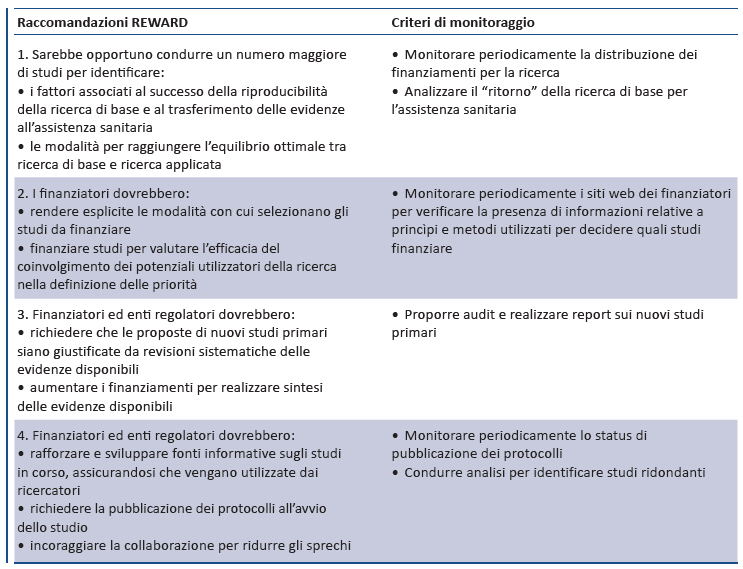
1. DEFINIZIONE DELLE PRIORITÀ DI RICERCA (8)
L’incremento degli investimenti nella ricerca biomedica ha generato notevoli miglioramenti di salute per pazienti e cittadini. Tuttavia, la maggior parte della ricerca non produce risultati rilevanti per la sanità , sia perché numerosi studi condotti con l’obiettivo di migliorare la conoscenza dei meccanismi di base sono irrilevanti per la salute, sia perché valide idee di ricerca spesso non forniscono i risultati attesi. Quanto più la definizione delle priorità di ricerca è oggettiva e trasparente, tanto più eventuali “delusioni” sui risultati non dovrebbero essere considerate come sprechi, bensì come parte integrante del processo scientifico. Tuttavia, considerato che alcune fonti di spreco non sono giustificabili sono state formulate le raccomandazioni 1-4 per i finanziatori della la ricerca che hanno la responsabilità primaria di ridurre sprechi conseguenti alla definizione delle priorità .
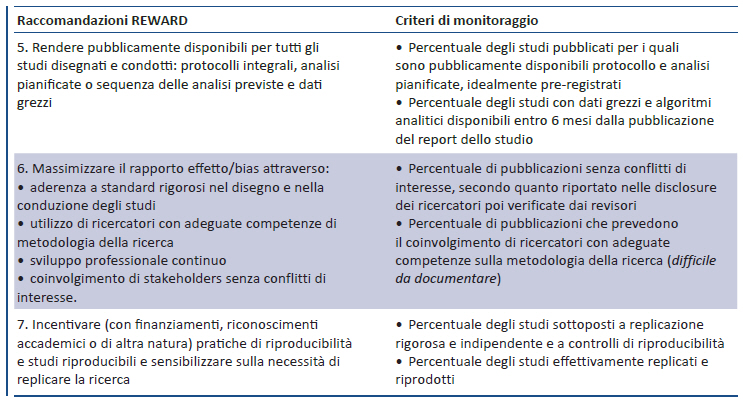
2. DISEGNO, CONDUZIONE E ANALISI DELLA RICERCA (9)
Numerose criticità nel disegno, conduzione e analisi della ricerca biomedica possono produrre risultati distorti generando sprechi: difficoltà di distinguere gli effetti di lieve entità dai bias introdotti nel disegno e nelle analisi dello studio; assenza di protocolli dettagliati e inadeguata documentazione; scarsa rilevanza e utilità delle informazioni ottenute; potenza statistica e precisione inadeguate o utilizzate in maniera distorta; limitata considerazione degli studi precedenti e di quelli in corso; scelta arbitraria delle analisi ed eccessiva enfasi su risultati estremi, spesso casuali. Diversi problemi sono correlati alle risorse umane impiegate nella ricerca: mancato coinvolgimento di statistici e metodologi, limitata formazione di ricercatori clinici e laboratoristi su metodologia e disegno della ricerca, coinvolgimento di stakeholders con conflitti di interesse, scarsa attenzione alla necessità di replicare la ricerca, sistemi premianti che oggi valorizzano la quantità più della qualità e la novità più dell’affidabilità . Le raccomandazioni 5-7 sono finalizzate a prevenire gli sprechi conseguenti a inadeguatezze nel disegno, conduzione e analisi della ricerca.
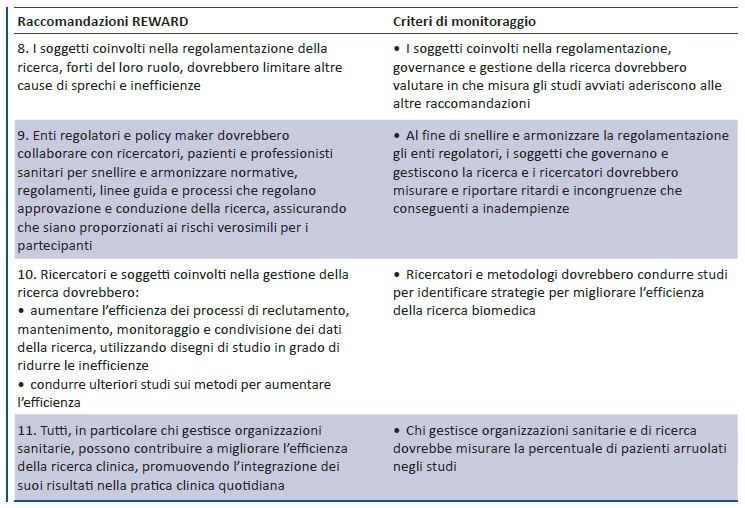
3. REGOLAMENTAZIONE E GESTIONE DELLA RICERCA (10)
Definito un quesito di ricerca rilevante e identificato un disegno di studio appropriato, possono insorgere sprechi negli aspetti di regolamentazione, governance e gestione della ricerca. Ottenere l’approvazione del comitato etico è diventato un processo sempre più oneroso e sproporzionato rispetto ai rischi reali per i partecipanti. Gli interventi previsti dai processi di regolamentazione e governance della ricerca, finalizzati a tutelare i partecipanti alla ricerca, a volte possono paradossalmente comprometterne gli interessi. Una gestione inefficiente della conduzione dei processi di ricerca è fonte di sprechi, specialmente se determina difficoltà di reclutamento e mantenimento dei pazienti arruolati in studi ben disegnati che affrontano quesiti di ricerca rilevanti. Queste fonti di spreco possono essere minimizzate grazie alle raccomandazioni 8-11.
4. MIGLIORARE L’ACCESSIBILITÀ ALLA RICERCA (11)
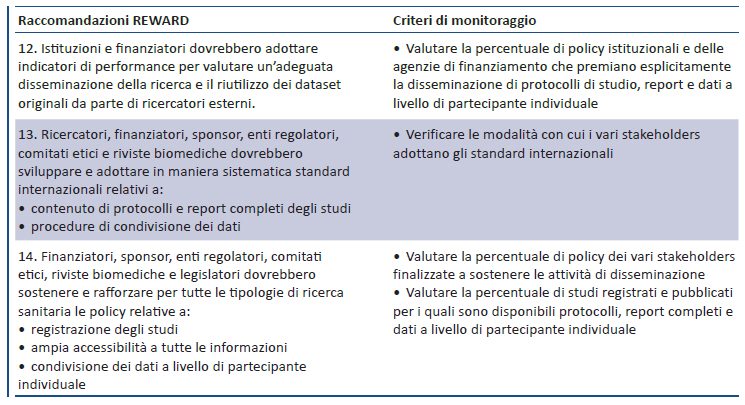
Metodi e risultati della ricerca sono contenuti in diverse fonti con variabile livello di dettaglio e completezza: protocolli degli studi, report completi (con i dettagli di tutte le analisi), report pubblicati su riviste biomediche, dataset a livello di partecipanti. Tuttavia, protocolli, report completi e dataset a livello di partecipanti raramente sono disponibili; inoltre i report pubblicati sulle riviste biomediche sono disponibili solo per il 50% degli studi condotti e sono negativamente influenzati dal reporting selettivo di metodi e risultati. Peraltro, anche quando disponibili, protocolli e report completi forniscono informazioni molto variabili in termini di qualità e spesso incomplete. In assenza di una completa accessibilità a tutte le informazioni ottenute dalla ricerca vengono introdotti numerosi bias, la ricerca e l’assistenza sanitaria vengono influenzate negativamente e si genera una ingente quantità di sprechi. Per migliorare l’accessibilità alla ricerca a livello di sistema sono state formulate le raccomandazioni 12-14.
5. MIGLIORARE COMPLETEZZA E USABILITÀ DELLA RICERCA (12)
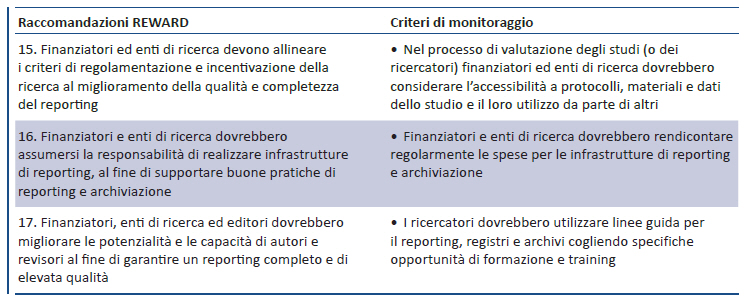
Se il reporting degli studi è inadeguato, il tempo e le risorse investite nella pianificazione, conduzione e analisi della ricerca rappresentano sprechi. Un adeguato reporting della ricerca dovrebbe descrivere chiaramente quali quesiti di ricerca vengono affrontati e perché, cosa è stato fatto, cosa è stato dimostrato, qual è il significato dei risultati ottenuti. Tuttavia, notevoli carenze nel reporting sono state identificate per ciascuno di questi elementi: studi condotti sui report di trial pubblicati mostrano che l’inadeguata descrizione degli interventi rende non replicabili il 40-89% degli studi; i confronti tra protocolli e pubblicazioni finali mostrano che nella maggior parte degli studi almeno un outcome primario è stato modificato, inserito o omesso; i ricercatori raramente inquadrano i risultati dei loro nuovi studi nel contesto di una revisione sistematica e citano una selezione molto limitata e distorta di rilevanti trial pregressi. Anche se meglio documentato per i trial controllati, il reporting inadeguato riguarda tutti i tipi di studi: ricerca pre-clinica, studi diagnostici, studi epidemiologici, ricerca predittiva, survey, ricerca qualitativa. Per tale ragione sono state elaborate numerose linee guida (CONSORT, STROBE, STARD, etc) finalizzate a migliorare la qualità del reporting, ampiamente sotto-utilizzate. Anche se è auspicabile una migliore comprensione degli articolati processi di conduzione, stesura e pubblicazione della ricerca, è possibile mettere in atto alcune azioni immediate per migliorare completezza e usabilità della ricerca grazie a un reporting ottimale (raccomandazioni 15-17).
Contributo degli Autori
-Disclosure dei conflitti di interesse
La Fondazione GIMBE aderisce alla campagna Lancet-REWARD.Indirizzo per la corrispondenza
nino.cartabellotta@gimbe.orgProvenienza
Non commissionato, non sottoposto a peer-review. REWARD Statement e raccomandazioni tradotte con permesso da: http://rewardalliance.net/reward-statement/Fonti di finanziamento
NessunaApprovazione comitato etico
-Ringraziamenti
Note alla versione italiana
La Fondazione GIMBE ha realizzato la traduzione italiana delle raccomandazioni e del REWARD Statement senza alcun finanziamento istituzionale o commerciale.
Team che ha realizzato la versione italiana
Responsabile scientifico
Antonino Cartabellotta, Fondazione GIMBE
Coordinamento editoriale
Marco Mosti, Fondazione GIMBE
Traduzione
Elena Cottafava, Fondazione GIMBE
Revisione editoriale
Roberto Luceri, Fondazione GIMBE
Pagina aggiornata il 27/maggio/2016



