Position Statement GIMBE
Evidence 2015;7(12): e1000127 doi: 10.4470/E1000127
Pubblicato: 9 dicembre 2015
Copyright: © 2015 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente lâutilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
I tumori rappresentano un rilevante problema di salute pubblica: nel 2011 in Italia sono la prima causa di morte tra gli uomini (34%) e la seconda fra le donne (25%) (1). Anche se morbilità e mortalità dei tumori possono essere ridotti da alcuni screening oncologici, occorre essere consapevoli che anche unâottimale implementazione di efficaci programmi di screening non permette comunque di azzerare la mortalità per cancro.
Le strategie di screening variano nella loro intensità (2): quelle ad elevata intensità si applicano a popolazioni più ampie (es. persone a basso rischio, più giovani o più anziane), con intervalli più brevi (es. cadenza annuale vs biennale) o con test diagnostici più sensibili [es. risonanza magnetica (RM) vs mammografia]. Lâobiettivo delle strategie di screening ad elevata intensità è quello di identificare il maggior numero di casi possibili, con la speranza che la diagnosi precoce coincida sempre con una riduzione della morbilità e della mortalità tumore-specifica.
Le strategie di screening variano anche in relazione al loro value che, secondo la definizione dellâAmerican College of Physicians (ACP) (3-5), è determinato dai benefici in termini di salute rispetto ai rischi e ai costi che comporta: strategie ad high value producono grandi benefici rispetto a rischi e costi associati, mentre quelle dal low value restituiscono benefici enormemente più piccoli rispetto a rischi e costi (4,6,7). Questa definizione è in linea con quella originale di Michael Porter, secondo cui il value è il rapporto tra outcome di salute e costi (8).
Anche se le strategie di screening ad elevata intensità hanno lâobiettivo di massimizzare lâidentificazione dei tumori, il value si ottimizza identificando il livello di intensità che garantisce il miglior profilo benefici/rischi e costi correlati (2). Di conseguenza, un programma di screening è considerato dal low value in due situazioni:
- underuse: i soggetti per i quali i benefici superano chiaramente rischi e costi non vengono sottoposti a screening in maniera sufficientemente intensiva (9,10);
- overuse: i soggetti sono sottoposti a screening in maniera troppo intensiva (3).
Numerosi studi documentano che gli screening troppo intensivi e dal low value sono comuni: ad esempio, al 20% delle donne di età compresa tra 30 e 39 anni viene raccomandata una mammografia e il 23-35% la esegue (11). La maggior parte delle donne che si sottopongono a mammografia lo fanno ogni anno (invece che ogni due). Un terzo dei medici di medicina generale prescrive screening con ecografia e RM, oltre alla mammografia, in donne senza un rischio aumentato di carcinoma della mammella (12). Tra le donne di età ≥80 anni lo screening per tumore cervicale e mammario viene effettuato rispettivamente nel 38% e nel 50% dei casi (13). Lo screening per tumore della cervice viene effettuato più precocemente e più frequentemente di quanto raccomandato (14). Nel 2002 circa il 70% delle donne senza cervice uterina ha effettuato un Pap test per lo screening del tumore alla cervice uterina (15). Negli USA circa 1.2 milioni di donne effettuano lo screening per il tumore dellâovaio16. Oltre il 40% degli internisti e quasi tutti i ginecologi intervistati in una survey dichiarano di avere effettuato lâesame pelvico annuale per lo screening del carcinoma ovarico o di altre neoplasie ginecologiche (17). Anche nello screening per il tumore del colon-retto le strategie low value sono comuni: il 60% degli adulti ha effettuato colonscopie più frequentemente di quanto raccomandato dalle linee guida e lo screening spesso viene eseguito in soggetti con aspettativa di vita ≤5 anni (18-20). Tra le persone che hanno effettuato uno screening con il sangue occulto nelle feci, lâ8% aveva avuto un risultato negativo meno di 1 anno prima (21). In relazione al controverso screening per il carcinoma della prostata, un terzo degli uomini effettua ogni anno il test con il PSA e il 50% degli uomini di età compresa tra 75 e 79 anni è stato recentemente sottoposto a screening (22). In generale, oltre il 50% di uomini e donne di età >75 anni dichiarano che i loro medici continuano a raccomandare lo screening (23).
La notevole diffusione di screening troppo intensivi consegue al fatto che esistono forti sollecitazioni verso lâapproccio della âmassima probabilità di identificare il cancroâ, piuttosto che verso quello basato sul value. Lâimportanza relativa di questi driver (box 1) (6,19,24-33) nel condizionare lâuso eccessivo di screening intensivi dal low value è poco studiata e rimane ampiamente sconosciuta. Tuttavia, molti fattori sembrano incoraggiare questo approccio, creando quella che è stata definita la âtempesta perfettaâ dellâoveruse (26). Negli ultimi anni numerose evidenze hanno ben documentato che il risvolto della medaglia degli screening intensivi si concretizza in rischi maggiori e costi più elevati (4,6,7). Questa progressiva consapevolezza ha portato a sviluppare una visione alternativa del profilo rischi-benefici-costi delle diverse strategie alla luce del loro value.
|
Box 1. Driver che alimentano lâutilizzo di strategie di screening dal low-value Conoscenze, attitudini e convinzioni delle persone
Conoscenze, attitudini e convinzioni dei medici
Sollecitazioni organizzative, legali, politiche e commerciali
|
1. Lâintensità degli screening oncologici
Il modo di concepire gli screening oncologici è importante per decidere lâintensità ottimale da raccomandare alle popolazioni a rischio. Lâapproccio corrente, generalmente guidato dallâobiettivo di massimizzare lâidentificazione dei tumori, dovrebbe essere sostituito dallâapproccio basato sul value, mirato a bilanciare i benefici dello screening con relativi rischi e costi, identificando la strategia che ottimizza questi trade off (figura 1). Gli screening dal low value a bassa intensità coincidono con strategie di screening efficaci sotto-utilizzate. Allâaumentare dellâintensità , che offre screening efficaci a persone che hanno minore accesso ai servizi, i benefici aumentano rapidamente, incrementando il value. Tuttavia, quando lâintensità dello screening cresce oltre il livello ottimale, lâaumento dei benefici rallenta mentre rischi e costi crescono rapidamente con conseguente riduzione del value.
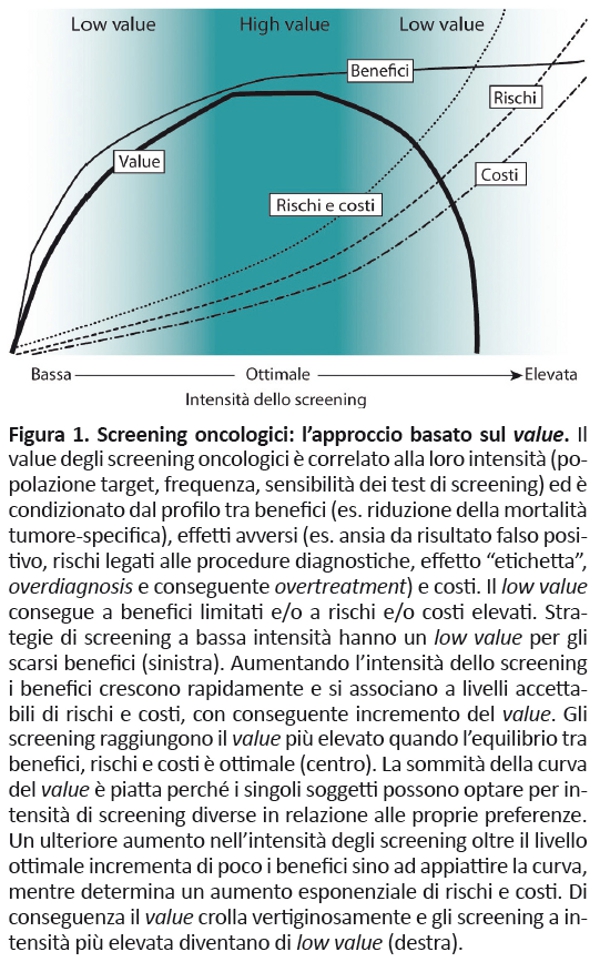
Numerose evidenze supportano lâapproccio basato sul value. Innanzitutto, trial rigorosi hanno dimostrato che gli screening per il carcinoma della mammella, del colon-retto e della cervice uterina riducono la mortalità tumore-specifica a un livello tale da giustificare rischi e costi correlati (34-36): tuttavia, non ci informano sullâintensità ottimale degli screening. Altri studi hanno dimostrato che aumentando lâintensità degli screening aumentano i falsi positivi, lâutilizzo di ulteriori test diagnostici, lâoverdiagnosis e i costi che la maggior parte delle persone — se adeguatamente informate — riterrebbero non giustificati dallâaumento incrementale dei benefici (37-40). Inoltre, diversi studi di modellizzazione hanno dimostrato che aumentando lâintensità degli screening oncologici diminuiscono i benefici e aumentano rischi e costi in conseguenza di ulteriori test diagnostici (41-44). Infine, anche ragionamenti teorici portano ad affermare che screening più intensivi, oltre ad essere più costosi, identificano inevitabilmente un numero maggiore di lesioni asintomatiche non evolutive, con conseguente aumento dei rischi (45-47).
2. Lâapproccio agli screening oncologici basato sul value.
Cinque sono i princípi chiave su cui si fonda questo nuovo approccio.
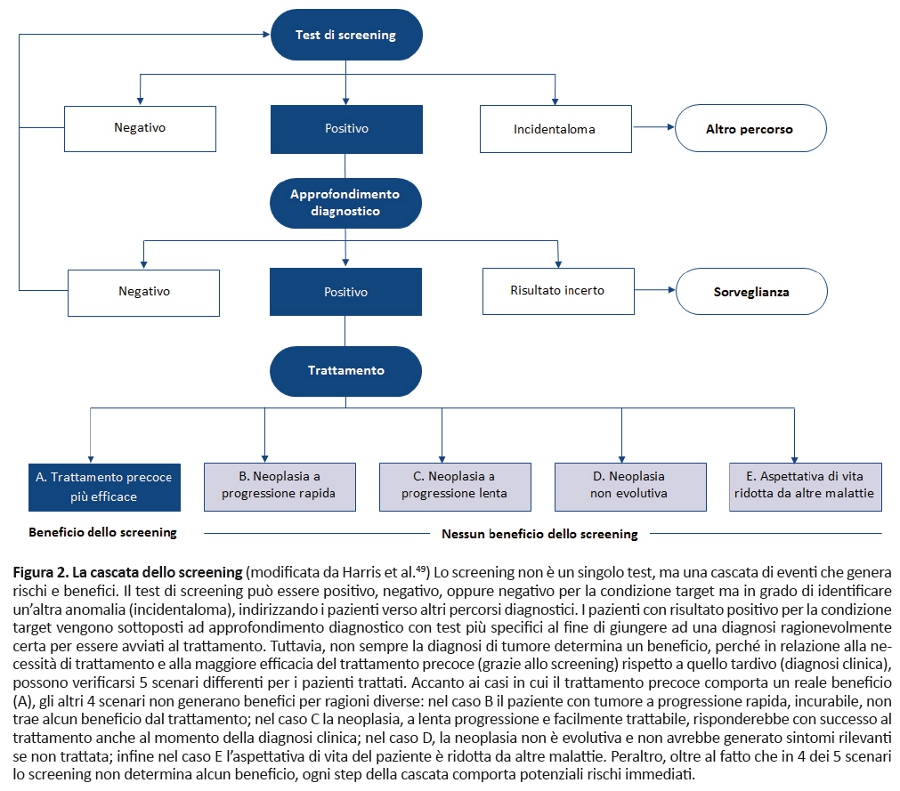
Key-point 1. Lo screening si configura come una cascata di eventi. Considerato che gli screening innescano una cascata di eventi in grado di condizionare benefici e rischi, il loro value è correlato a una ponderata valutazione di benefici vs rischi e costi dellâintera cascata e non del singolo test. I benefici interessano solo un sottogruppo di soggetti con risultati positivi (figura 2). Allâintensità ottimale, gli screening identificano la maggior parte dei casi di tumore responsivi a un trattamento precoce, con una bassa percentuale di falsi negativi (mai pari a zero). Aumentando lâintensità con lâobiettivo di identificare questi casi residui, cresce vertiginosamente il numero di test di screening e successivi approfondimenti diagnostici con conseguente identificazione sia di tumori che non beneficiano dal trattamento precoce, sia di lesioni non evolutive (overdiagnosis) con incremento di rischi e costi.
Key-point 2. La progressione dei tumori è eterogenea. Le strategie di screening di intensità ottimale mirano a rilevare le anomalie che hanno la maggior probabilità di generare problemi di salute e che sono trattabili con successo a uno stadio precoce, asintomatico. In generale, i tumori presentano tre tassi di progressione (figura 3):
- Rapida, con neoplasia spesso difficile da trattare (paziente 1)
- Intermedia, con tumore più responsivo al trattamento se identificato nella fase asintomatica (paziente 2)
- Lenta, dove il trattamento non è necessario in quanto il tumore non causerà mai sintomi (paziente 3). Gli screening identificano frequentemente questi tumori, generando overdiagnosis, perché rimangono più a lungo nella zona âidentificabile ma non sintomaticaâ; questo fenomeno aumenta parallelamente allâintensità degli screening (figura 1).
Gli screening oncologici in grado di determinare benefici a livello di popolazione, incrementando il value delle strategie di screening, sono quelli che identificano i tumori a progressione intermedia.

Key-point 3. I pazienti oncologici sono eterogenei. Le strategie di screening di intensità ottimale si concentrano su persone con fattori di rischio di neoplasie potenzialmente mortali e senza gravi comorbidità che possono ridurre lâaspettativa di vita. Lâoverdiagnosis, oltre allâidentificazione di tumori che progrediscono lentamente (paziente 3), consegue anche alla diagnosi di neoplasie in pazienti affetti da altre malattie che riducono lâaspettativa di vita a tal punto che il tumore non diverrà mai sintomatico (paziente 4). Chiarisce questo concetto lâesempio di una donna con carcinoma della mammella identificato attraverso un nodulo palpabile allâetà di 55 anni, che morirebbe a 65 anni a causa del tumore. Identificando la lesione a 52 anni grazie allo screening, un trattamento efficace permetterebbe alla donna di morire a 80 anni per altre cause. Di conseguenza, i benefici dello screening (15 anni guadagnati dopo i 65) iniziano a manifestarsi 13 anni dopo lâidentificazione del tumore. Tuttavia, se questa donna fosse affetta da un severo scompenso cardiaco con riduzione dellâaspettativa di vita a 70 anni, i benefici dello screening si ridurrebbero da 15 a 5 anni. Infine, in caso di comorbidità più numerose e gravi (es. diabete, insufficienza renale, cirrosi epatica) la sua aspettativa di vita sarebbe ulteriormente ridotta e lo screening non comporterebbe alcun beneficio (paziente 4). In questi pazienti lâidentificazione del tumore potrebbe generare anche effetti avversi, sia di natura psicologica (ansia) che fisica (riduzione della qualità /durata di vita conseguente al trattamento della neoplasia). Questo è un ulteriore fattore che spiega la diminuzione della pendenza nella curva dei benefici e lâaumento in quella dei rischi/costi in relazione alla crescente intensità degli screening (figura 1): la popolazione sottoposta a screening viene estesa in maniera eccessiva, includendo un numero sempre maggiore di persone con altre patologie.
Key-point 4. Gli screening determinano benefici rilevanti per alcuni tipi di tumore e per alcuni pazienti, ma possono comportare rischi importanti per molti altri. Per alcune persone e alcuni tipi di neoplasie gli screening possono generare benefici rilevanti in quanto riducono la mortalità tumore-specifica, nonostante il numero dei pazienti per i quali lo screening riduce la mortalità siano sorprendentemente pochi. Ad esempio, su un campione di 1.000 donne di 50 anni sottoposte a screening mammografico annuale per 10 anni vengono prevenute solo due morti per carcinoma della mammella (48). A fronte di questo beneficio esistono rischi reali per un numero molto più elevato di pazienti (49). Chi attraversa la cascata dello screening (figura 2) può incorrere in diversi rischi: per la salute fisica (es. complicanze legate ai test di screening o ai successivi test diagnostici), psicologica (es. ansia e insonnia nellâattesa dei risultati dello screening o dei successivi accertamenti diagnostici), perdita di opportunità (es. distrazione da altri significativi eventi della vita) ed economici (49). I rischi principali sono rappresentati da:
- Risultati falsi positivi, piuttosto comuni negli screening. Ogni 1.000 donne di 50 anni sottoposte a screening annuale per carcinoma mammario per 10 anni, circa 600 hanno almeno una mammografia con risultato falso positivo (48). Anche se lâansia per questi risultati falsi positivi è per lo più transitoria, specifiche preoccupazioni correlate alla malattia e pensieri intrusivi possono persistere in alcune donne, anche dopo la certezza di non avere un cancro (50,51).
- Overdiagnosis, genera rischi diversi e più persistenti. Per ogni 1.000 donne di 50 anni sottoposte a screening annuale per carcinoma della mammella per 10 anni, circa 7 vengono sovra-diagnosticate, ovvero ricevono una diagnosi di carcinoma mammario che non progredirà mai in maniera clinicamente rilevante (48). I rischi dellâoverdiagnosis sono di natura psicologica (la vita della donna cambia improvvisamente dopo essere stata etichettata come paziente oncologica (49)) e fisica (la donna viene esposta a rischi e effetti collaterali di ulteriori test diagnostici e trattamenti non necessari).
Key-point 5. Determinare il value delle strategie di screening è complesso, ma non impossibile. Per determinare il value è necessario ponderare benefici, rischi e costi dellâintera cascata di screening, ovvero prendere in considerazione il numero di persone che traggono beneficio (o incorrono in un rischio) e il tipo di beneficio (o rischio). Il numero di soggetti che sperimentano diversi effetti collaterali in seguito a screening è sempre maggiore rispetto alle morti per cancro evitate (46,49), ma il peso del beneficio individuale è spesso maggiore del rischio quando il parametro è costituito da morti evitate. Pertanto, il punto di equilibrio spesso si colloca tra molte persone che sperimentano un certo rischio vs poche che ottengono un grande beneficio.
Lâago della bilancia dovrebbe essere la voce dei cittadini informati, ma non ci sono certezze sulle modalità ottimali per includere questo parametro nella valutazione: una posizione estrema prevede che gli esperti esaminino i trade off, determinando a priori quale sarebbe lâopinione dei cittadini informati senza coinvolgerli; lâestremo opposto è che i singoli pazienti informati decidano per sé stessi il value di ciascuna strategia. Un ragionevole compromesso consiste nellâaffidare agli esperti (con adeguata supervisione) la determinazione del value in situazioni ragionevolmente chiare; mentre in quelle borderline, il value potrebbe essere determinato dallâinput dei singoli soggetti, utilizzando il processo decisionale condiviso per le scelte individuali o i metodi deliberativi (52) per quelle di politica sanitaria.
Nonostante i costi siano un elemento rilevante per determinare il value, trovare lâapproccio migliore per includerli nella valutazione dei benefici vs rischi e costi è problematico. Analisi di costo-efficacia (specialmente quelle che includono tutti i benefici, rischi e costi da una prospettiva sociale) e tabelle di outcome possono fornire informazioni sui trade off. Economisti e cittadini informati attraverso metodi deliberativi dovrebbero essere coinvolti nellâinserimento dei costi nel processo di valutazione del value.
3. Il value degli screening oncologici
LâACP negli ultimi anni ha enfatizzato la necessità di unâassistenza sanitaria dallâhigh value e consapevole dei costi (3-5,53) e, in linea con questi obiettivi, ha recentemente pubblicato due articoli (2,54) per aiutare i medici a determinare il value delle diverse strategie di screening oncologici (box 2). La Fondazione GIMBE, nellâambito della campagna âSalviamo il Nostro SSNâ, ha sviluppato il framework per il disinvestimento in sanità che prevede di ridurre lâutilizzo di servizi e prestazioni sanitarie dal low value per recuperare risorse da reinvestire in quelle ad high value. Condividendo princpi e metodi dellâACP, la Fondazione GIMBE ha adattato al contesto italiano le raccomandazioni per diffondere a livello professionale, manageriale, politico e sociale la consapevolezza di come si modifica il value degli screening in relazione alla loro intensità , applicando il framework alla valutazione di cinque screening oncologici. La tabella 1 riporta le strategie di screening raccomandate (high value) e quelle non raccomandate (low value) che dovrebbero guidare le strategie di politica sanitaria, la pratica professionale e lâinformazione ai cittadini. Il box 3, sulla base di tali raccomandazioni, formula suggerimenti pratici per i medici finalizzati ad incrementare il value degli screening oncologici, sia riducendo il sovra-utilizzo di test diagnostici dal low-value, sia incrementando gli screening ad high value, in particolare quelli offerti nellâambito dei programmi organizzati, spesso sotto-utilizzati.
|
Box 2. Metodologia
|
|
Box 3. 20 suggerimenti ai medici per promuovere screening oncologici ad high value nei soggetti asintomatici a medio rischio Carcinoma della mammella Carcinoma della cervice uterina Carcinoma del colon-retto Carcinoma dellâovaio Carcinoma della prostata |
3.1. Carcinoma della mammella. Sulla base dei trial controllati randomizzati â randomized controlled trials (RCT) - e dei relativi studi di modellizzazione, tutte le organizzazioni raccomandano lo screening mammografico o discussioni informate sullo screening, almeno ogni 2 anni per le donne di età compresa tra i 40 e i 74 anni (tabella 1) (9,55-57). Per le donne a medio rischio nessuna organizzazione raccomanda test di screening alternativi, quali la regolare e sistematica autopalpazione del seno, la RM o la mammografia 3D con tomosintesi. Non esistono sufficienti evidenze sui benefici dellâautopalpazione rispetto alla sola mammografia58. Strategie più intensive (es. screening a cadenza annuale, su gruppi di donne più giovani o più anziane, su soggetti di qualunque età con aspettativa di vita <10 anni, con utilizzo di test più sensibili) non sono raccomandate perché, oltre a un notevole incremento dei costi (59), genererebbero pochi benefici a fronte di un elevato aumento dei rischi, quali risultati falsi positivi e overdiagnosis/overtreatment di lesioni non progressive (13,53,60-62).
3.2. Carcinoma della cervice uterina. Sulla base di robusti studi osservazionali e di modellizzazione, tutte le organizzazioni raccomandano di iniziare allâetà di 21 anni lo screening con la citologia (Pap test) ogni 3 anni, indipendentemente dalla storia sessuale (56,63-65). Allâetà di 30 anni, le donne possono scegliere di continuare lo screening citologico a cadenza triennale oppure optare per una cadenza quinquennale associando al test citologico la ricerca del papillomavirus (HPV). Per le donne con precedenti risultati negativi lo screening può essere interrotto allâetà di 65 anni. Le ragioni per non sottoporre a screening donne di età <21 anni o >65 anni e di non effettuarlo più spesso di 3-5 anni conseguono al fatto che screening più intensivi genererebbero minori benefici a fronte di un elevato aumento di rischi (es. complicanze psicologiche e fisiche da colposcopia, follow-up dei risultati falsi positivi dello screening, overdiagnosis, overtreatment ) e costi.
3.3. Carcinoma del colon-retto. Sulla base dei risultati di RCT sullo screening con il test immunochimico fecale - fecal immunochemical test (FIT) - e la sigmoidoscopia e di consistenti studi osservazionali, tutte le organizzazioni raccomandano lo screening nei soggetti di età compresa tra 50 e 75 anni con una di queste 4 strategie: FIT ogni anno; sigmoidoscopia ogni 5 anni; colonscopia ogni 10 anni (9,56,66-69). Per il nuovo esame fecale del DNA, Cologuard (Exact Sciences), non esistono ancora dati di efficacia comparativa. Strategie di screening più intensive (es. screening nei soggetti di età <50 anni o >75 anni, cadenza più frequente di quella raccomandata, utilizzo di test non ancora raccomandati) riducono il value perché i benefici aumenterebbero di poco mentre crescerebbero notevolmente costi e rischi, tra cui le complicanze conseguenti al numero maggiore di colonscopie, overdiagnosis e overtreatment (68,70-72).
3.4. Carcinoma dellâovaio. Sulla base di numerosi RCT, tutte le organizzazioni raccomandano di non eseguire esami pelvici, dosaggio del CA-125 e ecografia transvaginale per lo screening del tumore ovarico (9,56,73-75). Nessun test di screening genererebbe benefici, ma incrementerebbe costi e rischi, tra cui le complicanze di ulteriori indagini invasive.
3.5. Carcinoma della prostata. Sulla base dei risultati dei RCT, nessuna organizzazione raccomanda il PSA per lo screening del tumore prostatico in assenza di una discussione informata sui benefici e rischi e di una preferenza esplicita del soggetto per lo screening (9,56,76-78). Il gruppo target è costituito da uomini tra 50 e 69 anni. Screening più intensivi (es. test generalizzati in assenza di specifica richiesta da parte di pazienti bene informati o su uomini di età diversa da quella sopra indicata) genererebbero benefici minimi a fronte del notevole incremento di costi e rischi, specialmente da biopsia prostatica, overdiagnosis e overtreatement (79-81).
4. Conclusioni
Nellâambito delle strategie di screening oncologico si assiste oggi ad un inaccettabile paradosso. Da un lato il sovra-utilizzo di screening dal low value che a fronte di benefici incerti presentano rischi reali e consumano preziose risorse.
Dallâaltro il sotto-utilizzo di strategie ad high value, efficaci nel ridurre la mortalià tumore specifica e offerte allâinterno dei programmi organizzati di screening. Ecco perchè per incrementare il value degli screening oncologici è necessario superare tre grandi sfide:
- implementare gli screening ad high value sottoutilizzati;
- ridurre lâuso di screening dal low value sovra-utilizzati;
- consolidare evidenze preliminari al fine di ridurre screening troppo intensivi attraverso le seguenti strategie (54):
- diminuire la frequenza degli screening
- interrompere gli screening dopo precedenti risultati negativi
- interrompere gli screening in soggetti con aspettativa di vita di <15-20 anni invece che < 10 anni
- iniziare lo screening a una età più avanzata o per sottogruppi a rischio aumentato facilmente identificabili
- utilizzare test di screening meno sensibili
- utilizzare soglie più alte per definire i risultati positivi dei test di screening
APPENDICE. GLI SCREENING ONCOLOGICI IN ITALIA
1. Screening oncologici nei livelli essenziali di assistenza
Negli ultimi dieci anni istituzioni nazionali e internazionali hanno sostenuto la prevenzione oncologica basata sullâattivazione di programmi organizzati di screening. In Italia le raccomandazioni per la pianificazione e lâesecuzione degli screening oncologici sono parte dellâattività del Ministero della Salute definita dalla L. 138 del 2004 (art. 2 bis), oltre che dal Piano Nazionale della Prevenzione 2005-2007 approvato con Intesa Stato-Regioni del 23 marzo 2005. Il DM 18 ottobre 2005 ha ricostituito i gruppi di lavoro sugli screening oncologici, con il compito di definire e mantenere costantemente aggiornate le raccomandazioni sugli screening oncologici che, secondo quanto riportato nellâUndicesimo Rapporto dellâOsservatorio Nazionale Screening1, includono nei livelli essenziali di assistenza (LEA) le prestazioni riporte nella tabella A1.
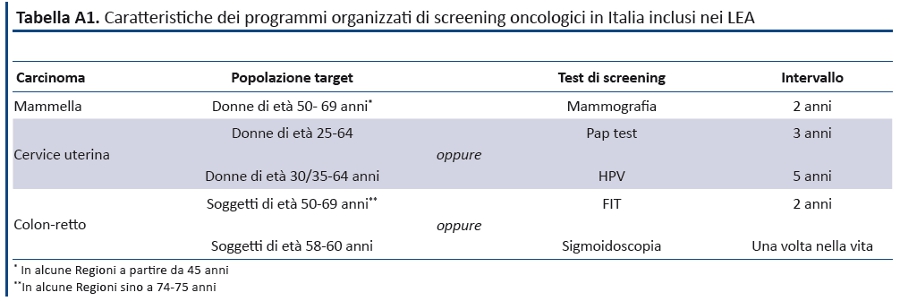
Tali prestazioni sono assolutamente in linea con le evidenze scientifiche disponibili; tuttavia, il value degli screening oncologici potrebbe essere incrementato prendendo in considerazione le seguenti strategie ad high value oggi non incluse nei LEA.
- Carcinoma della mammella: estendere lo screening mammografico nelle donne da 69 a 74 anni.
- Carcinoma della cervice uterina: estendere il Pap test nelle donne di età 21-24 anni e offrire il test combinato (Pap test + HPV), se la donna dopo i 30 anni opta per una frequenza quinquennale di screening.
- Carcinoma del colon-retto: estendere lo screening sino a 75 anni e offrire il test FIT ogni anno, oppure la sigmoidoscopia ogni 5 anni (eventualmente associata al FIT ogni 3 anni), oppure la colonscopia ogni 10 anni.
Per offrire tali strategie ad high value nei programmi di screening organizzato, le Regioni dovrebbero recuperare le risorse necessarie disinvestendo da tutte le strategie low value (tabella 1), formalmente non incluse nei programmi organizzati, ma ampiamente prescritte a carico del servizio sanitario nazionale.
2. Monitoraggio dei programmi di screening oncologici
La certificazione dellâadempimento relativo allâarea âmantenimento nellâerogazione dei LEAâ avviene attraverso lâutilizzo degli indicatori raccolti nella cosiddetta âGriglia LEAâ. Nellâarea della prevenzione lâindicatore numero 2 identifica la âProporzione di persone che ha effettuato test di screening di primo livello, in un programma organizzato, per cervice uterina, mammella, colon rettoâ. Lâobiettivo dellâindicatore è descrivere le attività dei programmi organizzati di screening e lâadesione da parte della popolazione eleggibile, fornendo una valutazione complessiva per i tre i programmi di screening. La proporzione delle persone che ha effettuato test di screening di primo livello, in un programma organizzato, viene calcolata utilizzando 3 indicatori:
- Carcinoma mammella: persone in età target che eseguono il test di screening/[donne residenti di età 50-69/2]*100.
- Carcinoma cervice uterina: persone in età target che eseguono il test di screening /[donne residenti di età 25-64/3]*100
- Carcinoma del colon-retto: persone in età target che eseguono il test di screening/[persone residenti di età 50-69)/2]*100
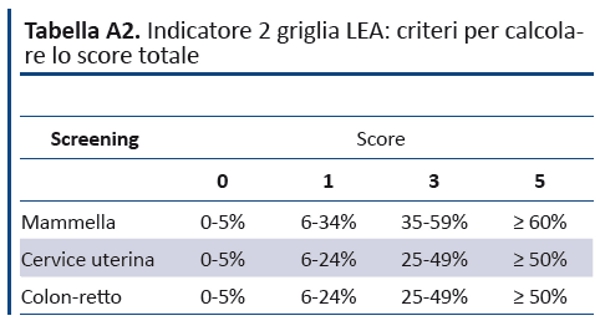
Per il numeratore vengono utilizzati i dati dellâOsservatorio Nazionale Screening; il denominatore è costituito dalla popolazione eleggibile per età , genere, età , regione di residenza secondo i dati ISTAT. Nel denominatore, la popolazione target viene divisa per la periodicità del round di screening, assumendo che le attività di invito del programma abbiano una frequenza costante. Lo score totale dellâindicatore è calcolato sommando gli score dei singoli programmi di screening a cui è attribuibile un punteggio che varia da 0 a 5 secondo la tabella A2. Ai fini dellâadempimento LEA a ciascuna regione viene assegnato uno score secondo i parametri riportati nella tabella A3.

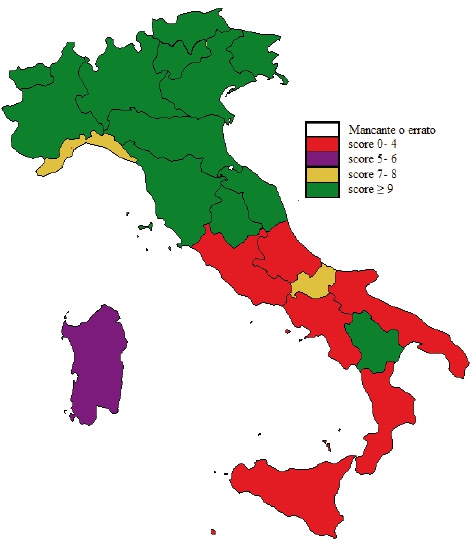
Nel 2013, lâadempimento âMantenimento dellâerogazione dei LEAâ attraverso gli indicatori della griglia LEA2, configura unâItalia spaccata in due con le eccezioni in negativo della Liguria al Nord e in positivo di Molise e soprattutto Basilicata al sud (figura A1). Tutto ciò, nonostante il Piano Screening 2007-20093 - approvato con il DM 8 giugno 2007 â abbia definito modalità e criteri di realizzazione dei programmi per il superamento delle criticità nelle Regioni meridionali e insulari e stanziato 41,5 milioni di euro per Abruzzo, Molise, Campania, Puglia, Basilicata, Calabria, Sicilia e Sardegna.
3. Lâanalisi della Fondazione GIMBE
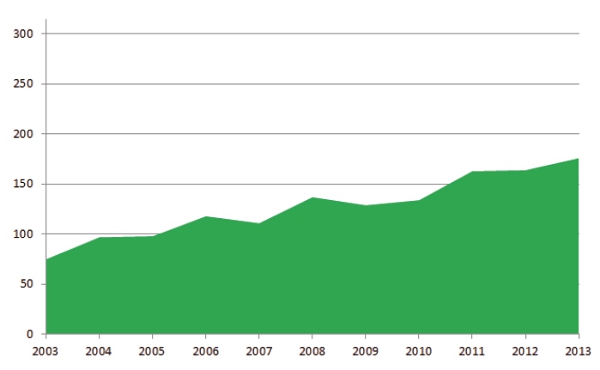
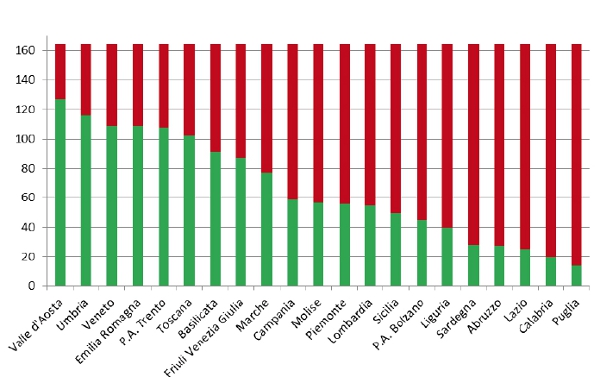
Integrando i dati 2013 con quelli del decennio 2003-2012 sullâadempimento dei LEA forniti dal Ministero della Salute4, è stata valutata la performance complessiva sullâadempimento agli screening oncologici in Italia. La figura A2 mostra che, grazie allâimplementazione dei programmi organizzati di screening, nel periodo 2003-2013 lo score cumulativo dei 21 sistemi sanitari regionali è progressivamente aumentato da 75 a 176, pur rimanendo molto lontano dallo score massimo di 315, garanzia di una copertura degli screening oncologici in almeno il 50% della popolazione target. Tuttavia, accanto a enormi differenze regionali sullâadempimento dei programmi organizzati di screening, anche numerose regioni del nord nel periodo 2003-2013 hanno ottenuto performance assolutamente inadeguate (figura A3). In particolare, rispetto allo score massimo di 165 ottenibile da ciascuna regione in 11 anni, il range oscilla da 127 punti della Valle DâAosta ai 12 della Puglia.
4. Conclusioni
Nonostante i limiti dellâindicatore LEA e la certezza che una percentuale di popolazione target effettua test di screening al di fuori dei programmi organizzati - come documentato dal sistema di sorveglianza PASSI5 - emerge il consistente sotto-utilizzo di screening oncologici efficaci nel ridurre la mortalità . A ciò si aggiunge lâinaccettabile livello di diseguaglianze regionali, a fronte delle stesse risorse messe a disposizione dallo Stato e, addirittura, incrementate da programmi ad hoc.
Ripartendo da queste diseguaglianze, nel Piano Nazionale della Prevenzione 2014-20186 la strategia âIdentificazione precoce con programmi di popolazione dei soggetti a rischio per i carcinomi della cervice uterina, della mammella e del colon retto per età â ribadisce come obiettivi principali:
- aumentare lâestensione reale dei programmi di screening alla popolazione target, per ognuno dei 3 tumori oggetto di screening;
- aumentare i soggetti a rischio sottoposti a screening oncologico;
- riorientare/avviare i programmi di screening per il cancro della cervice uterina introducendo il test HPV-DNA.
Disclosure dei conflitti di interesse
Nessuno dichiaratoIndirizzo per la corrispondenza
nino.cartabellotta@gimbe.orgProvenienza
Non commissionato, non sottoposto a peer-reviewFonti di finanziamento
NessunaApprovazione comitato etico
-Ringraziamenti
Si ringrazia per i preziosi suggerimenti Carlo Naldoni, già responsabile del programma di screening oncologico della Regione Emilia Romagna.
Pagina aggiornata il 9/dicembre/2015



