Editoriale
Evidence 2014;6(9): e1000088 doi: 10.4470/E1000088
Pubblicato: 24 settembre 2014
Copyright: © 2014 Cartabellotta. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
A 23 anni dalla sua nascita (1), l’Evidence-based Medicine (EBM) è stata recentemente dichiarata “ufficialmente in crisi” da Trisha Greenhalg et coll. (2) in quanto, concentrandosi eccessivamente su aspetti statistici e metodologici, ha perso di vista il suo vero obiettivo: migliorare la salute delle persone e ottimizzare l’utilizzo delle risorse grazie a un’adeguata integrazione delle migliori evidenze scientifiche in tutte le decisioni professionali, manageriali e di politica sanitaria. Secondo gli autori, portavoce del neonato Evidence-based Medicine Renaissance Group, il vero obiettivo dell’EBM consiste nel riportare la persona al centro delle cure e delle strategie di sanità pubblica.
Senza entrare nel merito della eccellente sintesi di tematiche di estremo interesse, nell’articolo stride il contrasto tra l’eccesso di enfasi nel titolo e nei toni e la totale assenza di approfondimento del problema reale su cui poggia l’intero movimento dell’EBM, ovvero l’articolato processo con cui la ricerca viene finanziata, prodotta e pubblicata generando le evidenze scientifiche su cui basare la medicina e l’assistenza sanitaria (3). Oggi, infatti, la ricerca biomedica è afflitta da un fenomeno imbarazzante e sempre più diffuso: numerose scoperte inizialmente promettenti non determinano alcun miglioramento nell’assistenza sanitaria. Ad esempio, di 1.575 articoli pubblicati nel 2005 sui markers prognostici del carcinoma prostatico, il 96% riportava almeno una variabile significativa (4), ma solo pochi sono stati confermati da studi successivi e solo un numero esiguo di markers è stato effettivamente introdotto nella pratica clinica (5). Perché dunque studi che hanno il potenziale di migliorare l’assistenza sanitaria e la salute delle popolazioni non riescono a centrare l’obiettivo primario della ricerca biomedica, ovvero concretizzare evidenze affidabili da integrare in tutte le decisioni che riguardano la salute delle persone?
Nel 2010, le spese globali per la ricerca scientifica (per lo più biomedica) ammontano ad oltre 240 miliardi di dollari (6); il contributo maggiore proviene dagli Stati Uniti, con circa 110 miliardi di dollari (70 dall’industria e 40 da istituzioni ed enti no-profit (7)), che rappresentano poco più del 5% della spesa sanitaria negli USA. Anche se questi considerevoli investimenti hanno già determinato rilevanti miglioramenti della salute delle popolazioni, potrebbero essere raggiunti ulteriori traguardi a patto di eliminare sprechi e inefficienze nei processi attraverso cui la ricerca viene commissionata, pianificata, condotta, analizzata, normata, gestita, disseminata e pubblicata.
Nel 2009, Chalmers et Glasziou (8) identificavano le principali fonti di sprechi evitabili nella ricerca biomedica: la loro somma ammonterebbe all’85% degli investimenti nella ricerca, pari a quasi 150 miliardi di euro nel 2010, senza tenere conto delle inefficienze presenti nelle fasi di regolamentazione e gestione della ricerca. La cifra appariva incredibile, tanto che la discussione innescata da quell’articolo ha generato un’ondata di seminari e incontri finalizzati ad esplorare strumenti e strategie per risolvere questa inaccettabile situazione: quesiti di ricerca inadeguati, cattiva qualità dei dis+egni di studio, inaccessibilità dei risultati della ricerca, risultati distorti da reporting selettivi e altri tipi di bias. Nonostante alcune delle problematiche identificate da Chalmers et Glasziou siano state recentemente affrontate (9-16), mantenendo questo passo saranno necessari moltissimi anni per mettere in atto tutte le azioni di miglioramento necessarie.
Il quadro sopra descritto poggia su un sistema complesso di azioni e relazioni tra diversi attori della ricerca biomedica, ciascuno dei quali agisce in sistemi con differenti rischi e fattori incentivanti. Le azioni possono essere comprese come risultato dell’interazione tra le capacità (intellettive e fisiche del singolo di affrontare le specifiche azioni), le opportunità (fattori esterni all’individuo che rendono possibili le azioni) e le motivazioni (driver che motivano e indirizzano il comportamento). Considerato che le azioni di ciascuna categoria di attori influenzano le altre, solo prendendo in considerazione tutti i driver è possibile comprendere le condizioni economiche, sociali, culturali e politiche che hanno plasmato l’universo della ricerca biomedica (11).
Nel mondo della ricerca biomedica i driver economici giocano, indubbiamente, un ruolo fondamentale: infatti, l’obiettivo principale dell’industria farmaceutica e biomedicale è quello di massimizzare i profitti sia immettendo continuamente nuovi prodotti, sia proteggendo ed espandendo le proprie quote di mercato. Nella ricerca clinica finanziata dall’industria, il disegno dello studio e la scelta dell’intervento di confronto (comparator) possono essere condizionate da ragioni di puro marketing; inoltre, sono sempre più diffusi i cosiddetti trial di disseminazione (seeding trials), condotti con l’obiettivo primario di rendere familiari i nuovi farmaci, piuttosto che generare nuove conoscenze (12). Gli interessi economici dell’industria hanno contribuito a trasformare la salute in una merce che può essere acquistata, un messaggio che distorce notevolmente la percezione di altri stakeholders, in particolare di cittadini e pazienti. Più in generale, la logica del profitto rimane centrale per tutto quanto coinvolge l’industria, incluse le interazioni con ricercatori e professionisti sanitari che nella maggioranza dei casi sono indipendenti solo in apparenza (13).
Anche le riviste biomediche rappresentano un business molto redditizio: di conseguenza, i tentativi di massimizzare gli introiti non sono sempre compatibili con l’obiettivo di pubblicare esclusivamente studi di elevata qualità e rilevanti per la salute pubblica. Infatti la peer review, che dovrebbe garantire la qualità delle pubblicazioni, è un meccanismo largamente imperfetto e poco costo-efficace, considerati anche i costi molto elevanti (14,15). Nel dicembre 2013 Randy Schekman, in occasione della consegna del Nobel per la Fisiologia o la Medicina ha lanciato un feroce attacco contro quelle che ha definito “riviste di lusso” – Nature, Science e Cell. Nonostante non abbia direttamente menzionato i “top five journals” (New England Journal of Medicine, The Lancet, JAMA, Annals of Internal Medicine, BMJ), è ragionevole pensare che la definizione includesse anche quelle. Sul Guardian ha dichiarato che: “Le riviste di lusso dovrebbero costituire paradigmi di qualità e pubblicare solo la ricerca migliore. Considerato che i panel che decidono di finanziamenti e nomine spesso utilizzano la rivista di pubblicazione come indicatore proxy per la qualità della ricerca, pubblicare su queste testate spesso garantisce finanziamenti e cattedre. Tuttavia, la reputazione di cui godono queste importanti riviste è meritata solo in parte, perché se è assolutamente certo che pubblicano numerosi articoli rilevanti, è altrettanto vero che non pubblicano esclusivamente quelli, né sono le uniche a pubblicare ricerca rilevante” (17).
Governi e politici giocano un ruolo determinante perché i finanziamenti per la ricerca sono indispensabili in aree rilevanti per la salute pubblica, ma ignorate dall’industria perché le opportunità di profitto sono minime o nulle. Anche se i finanziatori istituzionali non sono generalmente guidati da logiche di profitto, occorre non sottovalutare altri aspetti rilevanti: le agenzie nazionali ricevono i fondi dai governi, guidati dalla politica che, per dimostrare il successo di una strategia di finanziamento che assicura lavoro ai ricercatori, si basa in parte sui risultati ottenuti in tempi brevi. Poiché i frutti di decisioni strategiche sulla ricerca emergono solo dopo molti anni, chi deve erogare finanziamenti pubblici per la ricerca si basa spesso su indicatori surrogati spesso indebitamente influenzati sia dall’entità del finanziamento, sia dall’impact factor delle riviste, che non rappresentano misure affidabili della qualità della ricerca, né tantomeno della loro rilevanza clinica e sociale (18).
Le agenzie regolatorie e i comitati etici, memori delle atrocità del passato associate alle ricerche biomediche dei criminali di guerra (es. trial di Norimberga) (19), hanno il compito di proteggere i partecipanti arruolati nella ricerca. Oggi tuttavia, l’impatto degli adempimenti regolatori è spesso sproporzionato rispetto ai plausibili rischi connessi alla ricerca (20), condizionando negativamente capacità e motivazioni dei ricercatori nel rispondere a quesiti rilevanti per l’assistenza sanitaria.
I fattori sociali e culturali, accanto a quelli economici e politici, giocano un ruolo rilevante. La scienza non è fatta da modelli virtuosi, ma da esseri umani orientati ai propri interessi che possono compromettere i loro consueti elevati standard di rigore morale se coinvolti in relazioni commerciali o conflitti di interesse di altra natura. Quando le risorse scarseggiano e la competizione è molto elevata, i ricercatori possono optare per la strada più facile e veloce, piuttosto che la migliore, scegliendo di arrivare primi a scapito della correttezza. Se la loro ipotesi di ricerca si rivela errata, molti ricercatori preferiscono passare a un altro studio piuttosto che dedicarsi a un reporting scrupoloso di risultati negativi. Infine, possono prediligere studi stimolanti per il mondo scientifico, rispetto a quelli che tentano di rispondere a quesiti veramente rilevanti per i pazienti e i sistemi sanitari. Questi comportamenti sono ulteriormente aggravati dalla compiacenza e dalla povertà intellettuale di alcuni ricercatori. Se, di fatto, la ricerca così condotta continua ad essere finanziata e pubblicata, perché cambiare? Chi dovrebbe mai scoprire eventuali loro carenze in termini di capacità , attenzione e scrupolosità ?
Enti di ricerca e istituzioni accademiche hanno un ruolo fondamentale nel costruire il contesto sociale e culturale in cui viene realizzata la ricerca: infatti le regole accademiche di incentivazione e promozione influenzano inevitabilmente le scelte dei ricercatori in ogni fase della loro carriera. Concentrare l’attenzione sulla pubblicazione dei risultati su riviste con elevato impact factor e sull’acquisizione dei finanziamenti induce i ricercatori a inseguire il successo a breve termine, piuttosto che condurre studi robusti che impiegherebbero più tempo per produrre risultati meno eclatanti, ma più validi e rilevanti per la salute pubblica. Inoltre, le istituzioni accademiche non sono ancora riuscite a stabilire meccanismi credibili per identificare e gestire una cattiva condotta della ricerca. Una posizione in netto contrasto con quanto accade in ambito industriale, dove nel 2013 un ricercatore è stato condannato per aver falsificato i risultati di ricerche di laboratorio (21).
Il fatto che gli studi siano sottoposti a peer review e che le decisioni su finanziamento, pubblicazione e promozione non vengano assunte dai singoli genera un falso senso di indipendenza. A ogni livello, ciascun individuo coinvolto in questi processi è influenzato da differenti driver, quali l’ambizione, la progressione di carriera e il finanziamento. I giovani ricercatori, poco propensi a sfidare l’autorità e infrangere lo status quo, sono portati a pensare che le migliori chances di successo si ottengono lavorando per il sistema, e non cercando di cambiarlo.
Quali possibili soluzioni per cambiare la rotta di un sistema ormai alla deriva? Una barriera a tutti i driver che generano distorsioni potrebbe essere rappresentata da contro-influenze di bilanciamento: invece di essere giudicati sulla base dell’impact factor delle riviste che pubblicano i loro studi, gli accademici potrebbero essere valutati in base al rigore metodologico, alla completa disseminazione delle loro ricerche, alla qualità dei loro report e alla riproducibilità dei loro risultati, in altre parole alla rilevanza clinica e sociale delle evidenze da loro prodotte. Se questi elementi avessero un ruolo sostanziale per le decisioni relative alle promozioni di carriera, al finanziamento e alla pubblicazione, le istituzioni potrebbero utilizzarli per valutare le performance del proprio personale e, se al di sotto di certi standard, impegnarsi per il loro miglioramento.
Oggi tutti gli attori coinvolti agiscono ciascuno per il proprio interesse, troppo spesso aumentando gli sprechi e riducendo il valore della ricerca biomedica: è arrivato il momento di dare nuovo vigore al processo scientifico e promulgare i suoi principi guida. Sono necessari nuovi sistemi di supervisione e regolamentazione al fine di promuovere il rigore metodologico, proteggere l’integrità del processo scientifico e allontanare i ricercatori da influenze perverse. Assicurando rigore in tutte le fasi del processo di ricerca, la comunità scientifica potrebbe proteggere se stessa dai sofismi della politica, separare le conflittuali logiche capitalistiche da quelle della scienza e dare reale valore al denaro dei finanziatori liberali e dei contribuenti, aumentando il value e riducendo gli sprechi della ricerca.
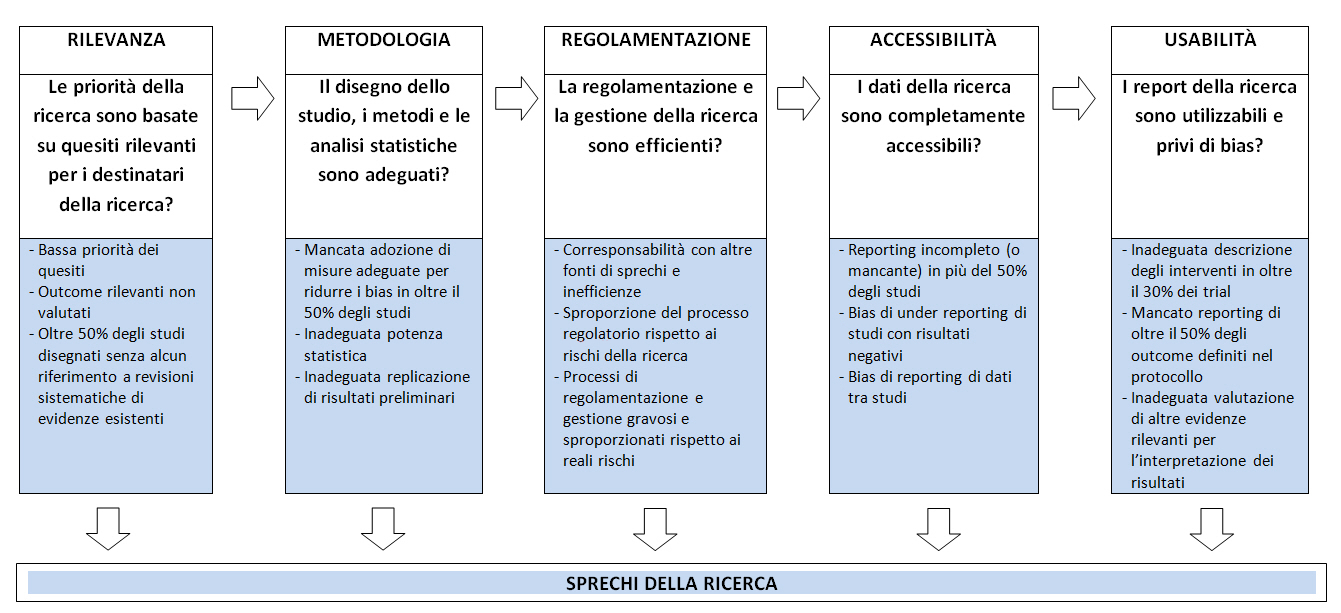
A questo tema di estrema attualitĂ la rivista The Lancet ha dedicato la serie Research: Increasing Value, Reducing Waste dove gli autori formulano specifiche raccomandazioni per incrementare il valore e ridurre gli sprechi della ricerca (22-26). È di grande lustro per il nostro Paese che l’editoriale che ha presentato la serie — oltre ad aggiornare le categorie di sprechi di Chalmers e Glasziou (8) (figura) — indichi nell’Istituto di Ricerche Farmacologiche Mario Negri un paradigma istituzionale per la ricerca (box).
Nel suo attacco alle “riviste di lusso” Schekman ha lanciato una provocazione (17): “In che modo le riviste scientifiche dovrebbero contribuire ai progressi della scienza e delle carriere?”. Domanda legittima, ma incompleta: oggi infatti le evidenze disponibili suggeriscono un interrogativo ancora più ampio: come dovrebbe cambiare l’intero sistema-scienza per aumentare la produzione di evidenze affidabili e accessibili, raccogliendo le sfide della società e rispondendo ai bisogni delle persone (28)?
Sicuramente, l’annunciato rinascimento dell’EBM proposto da Trisha Greenhalgh non può che ripartire dallo slogan “meno pubblicazioni e più evidenze!”
|
Box. L’Istituto di Ricerche Farmacologiche Mario Negri: un modello patient-oriented per lo sviluppo, la valutazione e l’impatto dei farmaci nella pratica (29)
|
Affiliazione degli Autori
Antonino Cartabellotta, Medico Chirurgo, Fondazione GIMBE
Contributo degli Autori
-Disclosure dei conflitti di interesse
AC è il Presidente del GIMBE, organizzazione no-profit che svolge attività di formazione e ricerca sugli argomenti trattati nell’articoloIndirizzo per la corrispondenza
nino.cartabellotta@gimbe.orgProvenienza
Non commissionato, non sottoposto a peer-reviewFonti di finanziamento
NessunaApprovazione comitato etico
-Pagina aggiornata il 24/settembre/2014



