Guidelines & Standards
Evidence 2012;4(6): e1000022 doi: 10.4470/E1000022
Pubblicato: 24 ottobre 2012
Copyright: © 2012 Qaseem. Questo è un articolo open-access, distribuito con licenza Creative Commons Attribution, che ne consente l’utilizzo, la distribuzione e la riproduzione su qualsiasi supporto esclusivamente per fini non commerciali, a condizione di riportare sempre autore e citazione originale.
Le metodologie di produzione delle linee guida (LG) per la pratica clinica sono estremamente variabili, e molte LG non soddisfano i requisiti minimi di qualità. La definizione di standard per lo sviluppo di LG è utile sia alle organizzazioni che producono LG, tenute a garantire raccomandazioni cliniche evidence-based, sia agli utenti per selezionare LG di elevata qualità. Alcune organizzazioni, come l’Institute of Medicine (USA) e il National Institute for Health and Clinical Excellence (UK), hanno già sviluppato proprie raccomandazioni per produrre LG affidabili. Tuttavia, molti gruppi impegnati nella produzione di LG le hanno ritenute impossibili da seguire integralmente perché prevedono un numero troppo elevato di standard.
Il Guidelines International Network (G-I-N), fondato nel 2002, è un network a cui appartengono 93 organizzazioni che producono LG e 89 membri individuali, che complessivamente rappresentano 46 paesi. Il Consiglio Direttivo del G-I-N ha avviato un percorso per raggiungere un consenso sui requisiti minimi necessari per produrre LG di elevata qualità, riconoscendo che le metodologie di produzione delle LG devono essere, al tempo stesso, rigorose e applicabili anche per organizzazioni che dispongono di finanziamenti modesti.
Diversamente da altri standard nazionali o locali, la proposta del G-I-N rappresenta il consenso raggiunto da un gruppo internazionale multidisciplinare costituito da professionisti impegnati attivamente nella produzione di LG.
Questo articolo presenta i requisiti fondamentali proposti dal G-I-N per la produzione di LG affidabili di elevata qualità: la composizione del gruppo di lavoro, il processo decisionale, i conflitti di interesse, gli obiettivi, le metodologie di produzione, la revisione delle evidenze, la base delle raccomandazioni cliniche, il rating delle evidenze e delle raccomandazioni, i processi di revisione, aggiornamento e finanziamento delle linee guida.
È auspicabile che questo articolo promuova la discussione e l’eventuale accordo su un set di standard internazionali per produrre LG di elevata qualità.
Tutte le professioni sanitarie contano molto sull’integrazione delle evidenze scientifiche nelle linee guida (1) (LG), definite dall’Institute of Medicine (IOM) “documenti che contengono raccomandazioni finalizzate a migliorare l’assistenza ai pazienti, basate su una revisione sistematica delle evidenze e sulla valutazione di benefici e rischi di opzioni alternative” (2). Negli ultimi decenni, il numero di LG prodotte in tutto il mondo, sia da istituzioni governative che da organizzazioni private, è aumentato in maniera esponenziale, tanto che medici, pazienti e altri stakeholders devono spesso destreggiarsi tra numerose LG di variabile qualità, talvolta anche discordanti (3).
La produzione di LG nell’ambito di programmi coordinati può facilitare il raggiungimento di standard di qualità grazie a una efficiente condivisione di risorse e competenze (4); inoltre una collaborazione internazionale offre ulteriori opportunità per migliorare la produzione di LG (4). La definizione di standard per lo sviluppo delle LG è utile sia alle organizzazioni che producono LG, tenute a garantire raccomandazioni cliniche evidence-based, sia agli utenti per identificare LG di elevata qualità. L’AGREE (Appraisal of Guidelines for Research and Evaluation), anche se non definisce esplicitamente gli standard per la produzione delle LG, costituisce un prezioso strumento per valutare il processo di sviluppo delle LG (4).
Numerose istituzioni, quali l’IOM (2), l’Organizzazione Mondiale della Sanità (5), il National Institute for Health and Clinical Excellence (6), lo Scottish Intercollegiate Guidelines Network (7), il National Health and Medical Research Council (8), molte società scientifiche (9-15) e altre organizzazioni (16-24) hanno elaborato standard per la produzione di LG. Tuttavia, i recenti report dell’IOM sui criteri di affidabilità delle LG e delle revisioni sistematiche (2,25) hanno suscitato pareri discordanti. In particolare destano perplessità sia la possibilità concreta di implementare la lunga lista di standard, sia la loro applicabilità in setting differenti (26).
Il Guidelines International Network (G-I-N) è un network (www.g-i-n.net) fondato nel 2002, a cui appartengono 93 organizzazioni che producono LG e 89 membri individuali, che complessivamente rappresentano 46 Paesi (dati aggiornati a gennaio 2012) (27). La sua biblioteca on-line raccoglie oltre 7.400 documenti, di cui 3.636 LG, molto variabili in termini di qualità. Il G-I-N riconosce la necessità di minimizzare le differenze di qualità tra le LG e di promuovere lo sviluppo di LG affidabili. In risposta alla richiesta di standard internazionali per la produzione e la valutazione delle LG (19,28-30), il consiglio direttivo (CD) del G-I-N ha effettuato una revisione della letteratura e utilizzato un processo di consenso per proporre un set di requisiti fondamentali per la produzione di LG.L’obiettivo è avviare una discussione globale e raggiungere il consenso sugli standard minimi per la produzione delle LG
METODI
Il CD del G-I-N è formato da medici e altri professionisti impegnati nella produzione di LG, con specifiche competenze in evidence-based medicine e nelle metodologie di sviluppo e implementazione di LG. Se i componenti del CD rappresentano diverse aree geografiche (Nord America, Europa, Australia, Asia), gli autori di questo articolo, membri del CD del G-I-N, non sono stati selezionati per rappresentare specifiche organizzazioni.
Grazie a una ricerca bibliografica effettuata su varie fonti (PubMed, siti web di organizzazioni che producono LG, Google e Google Scholar), sono stati identificati rilevanti manuali, protocolli e articoli relativi allo sviluppo di LG (2,4-7,9-25,27-115). Ulteriori fonti sono state identificate analizzando le voci bibliografiche dei documenti reperiti. La ricerca bibliografica è stata effettuata, senza applicare alcuna restrizione linguistica, sino a ottobre 2011.
Abbiamo identificato i criteri fondamentali per la produzione di LG di elevata qualità, considerando gli aspetti pratici correlati alla loro inclusione nel processo di sviluppo, implementazione e adattamento di LG. Nella lista dei requisiti riportati in questo articolo sono stati inclusi solo quelli considerati essenziali per lo sviluppo di LG. Abbiamo selezionato tali requisiti attraverso un processo di consenso informale e sottoposto l’articolo al CD del G-I-N per l’approvazione finale. Considerato che questo articolo ha l’obiettivo di avviare un dibattito per future revisioni o sviluppi degli standard proposti, abbiamo preferito un approccio informale per includere tutte le differenti opinioni e i punti di vista.
REQUISITI FONDAMENTALI DI UNA LINEA GUIDA AFFIDABILE DI ELEVATA QUALITÀ
La produzione di una LG per la pratica clinica prevede varie fasi, ciascuna delle quali può essere gestita con diversi gradi di rigore. Riteniamo che gli 11 requisiti proposti rappresentino i criteri minimi fondamentali di una LG affidabile di elevata qualità (tabella). Il G-I-N raccomanda ai professionisti impegnati nella produzione di LG di soddisfare tali criteri e di valutare l’eventuale necessità di adattamento locale. Nei documenti che riportano i metodi utilizzati per la produzione della LG, le organizzazioni dovrebbero specificare come hanno soddisfatto ciascuno dei requisiti.
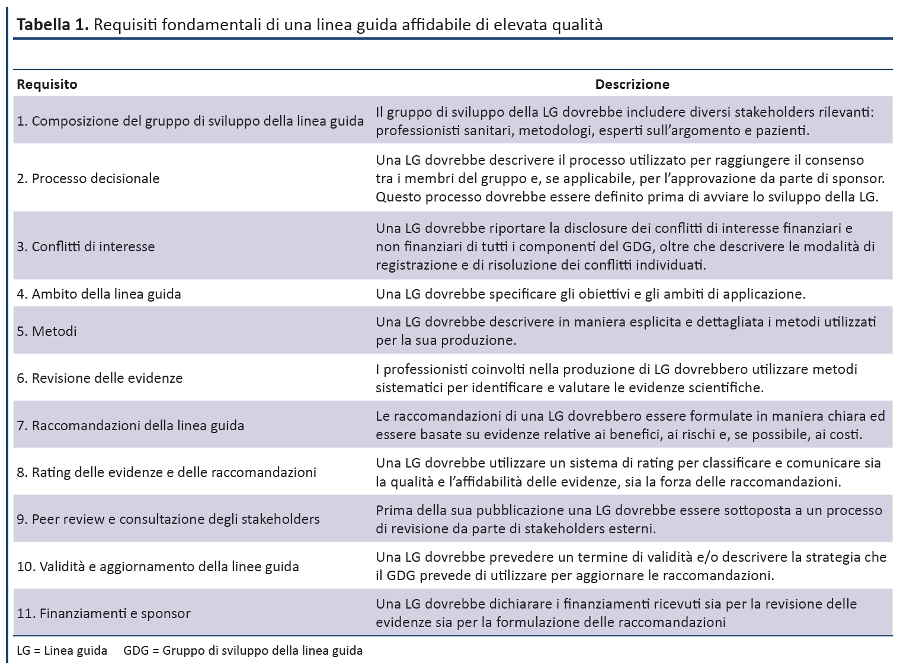
1. Composizione del gruppo di sviluppo della linea guida
Il gruppo di sviluppo della LG dovrebbe includere diversi stakeholders rilevanti: professionisti sanitari, metodologi, esperti sull’argomento e pazienti.
Il gruppo di sviluppo della LG - Guideline Development Group (GDG) - oltre a essere responsabile della revisione delle evidenze, della loro integrazione nelle raccomandazioni cliniche e della stesura della LG, assicura che le raccomandazioni siano basate sulle migliori evidenze scientifiche disponibili, senza essere distorte da altri fattori. Considerato che GDG non multidisciplinari possono produrre raccomandazioni cliniche non evidence-based (53,72,75,80,102), un GDG ideale dovrebbe includere diversi stakeholders rappresentativi di: professionisti sanitari, esperti sul tema, metodologi con competenze nella valutazione e sintesi delle evidenze e, idealmente, anche economisti sanitari, cittadini e pazienti.
Considerato che un GDG non equilibrato può formulare raccomandazioni inaffidabili (90), un coordinatore efficiente e neutrale dovrebbe guidare il GDG per garantire contributi equilibrati da parte di tutti i membri. Il coordinatore del GDG deve avere una conoscenza generale dell’argomento, ma non deve necessariamente essere un esperto, perché il suo ruolo principale è quello di facilitare la discussione e raggiungere il consenso. Infatti, eventuali preconcetti di un coordinatore esperto sul tema della LG rischiano di determinare bias.
Anche la dimensione del GDG è importante: se gruppi troppo numerosi possono essere difficili da gestire, piccoli gruppi potrebbero non essere rappresentativi di tutte le categorie rilevanti di stakeholders. Sebbene non siano disponibili adeguate evidenze sulla giusta dimensione del GDG (2), la nostra esperienza suggerisce che gruppi costituiti da 10-20 componenti sono adeguati.
Il coinvolgimento ottimale di o pazienti e cittadini nel processo di produzione delle LG è un argomento molto dibattuto (77,84,98,116). Infatti, se le loro opinioni sulla qualità di vita correlata a diverse malattie o a specifici interventi sanitari possono essere preziose77, la limitata cultura medico-scientifica e metodologica possono ostacolare un processo evidence-based. Quando cittadini e pazienti hanno diritto di voto all’interno del GDG, è opportuno prevedere interventi di formazione e supporto per consentire loro di svolgere adeguatamente il ruolo assegnato. Al fine di determinare modalità e strategie per coinvolgere in maniera efficace cittadini, pazienti e loro familiari nel processo di sviluppo delle LG, è stato costituito il G-I-N PUBLIC (www.g-i-n.net/activities/gin-public).
2. Processo decisionale
Una LG dovrebbe descrivere il processo utilizzato per raggiungere il consenso tra i membri del gruppo e, se applicabile, per l’approvazione da parte di sponsor. Questo processo dovrebbe essere definito prima di avviare lo sviluppo della LG.
La produzione di LG, anche quando evidence-based, è un processo che richiede il consenso del GDG per selezionare e interpretare le evidenze, per integrarle nelle raccomandazioni cliniche, per determinare come gestire le aree grigie dove non esistono evidenze per rispondere a rilevanti quesiti clinici. Solo alcune organizzazioni utilizzano processi di consenso formale, mentre la maggior parte si affidano a processi informali.
Esempi di processi di consenso formale sono la tecnica del gruppo nominale, il metodo Delphi, la votazione formale (50,52,109). Il processo di consenso informale consiste, invece, nel mancato utilizzo di metodi strutturati per raggiungere il consenso. È dimostrato che dai metodi di consenso formale, rispetto a quelli informali, derivano processi più evidence-based e meno influenzati da bias (72,80,100). Indipendentemente dai metodi utilizzati, la LG dovrebbe definire chiaramente un quorum e documentare il processo di consenso (50,52,109).
3. Conflitti di interesse
Una LG dovrebbe riportare la disclosure dei conflitti di interesse finanziari e non finanziari di tutti i componenti del GDG, oltre che descrivere le modalità di registrazione e di risoluzione dei conflitti individuati.
Le policy per la dichiarazione e la gestione dei conflitti di interesse - conflicts of interest (COI) - variano notevolmente tra le varie organizzazioni (2). I COI sono “varie circostanze che espongono al rischio che il giudizio professionale o le azioni riguardanti un interesse primario vengano indebitamente influenzate da un interesse secondario” (117). I membri del GDG devono dichiarare tutti i COI finanziari e non finanziari personali o familiari correlati all’argomento della LG. Se un membro del GDG o un suo familiare ha un potenziale o mancato guadagno rilevante di tipo finanziario, non finanziario, professionale o personale correlato all’argomento della LG, questo deve essere esplicitamente dichiarato e riportato dalla LG.
I COI finanziari includono la proprietà di azioni o quote, il lavoro subordinato o di consulenza, l’appartenenza a commissioni che erogano finanziamenti, le richieste di brevetto, i grant di ricerca (da qualsiasi fonte, con o senza restrizioni), gli onorari e i regali. I COI non finanziari includono la presidenza o l’appartenenza a consigli e comitati, il coinvolgimento in un gruppo di interesse che può trarre vantaggi dalla LG, scrivere o fornire consulenze per società di formazione, avere convinzioni personali (politiche, religiose, ideologiche, etc) correlate all’argomento della LG che possono influenzare la revisione delle evidenze o lo sviluppo delle raccomandazioni. Il GDG e gli eventuali sponsor devono gestire in maniera proattiva e trasparente i COI valutando il livello di rischio e, se necessario, escludendo i membri del gruppo con COI rilevanti dalle principali discussioni e decisioni.
4. Ambito della LG
Una LG dovrebbe specificare gli obiettivi e gli ambiti di applicazione.
La LG dovrebbe indicare chiaramente gli obiettivi e i principali quesiti affrontati. L’ambito include i criteri diagnostici, i benefici e gli effetti avversi delle varie opzioni di trattamento, i principali esiti valutati, la popolazione target e i potenziali utenti della LG (62,101).
5. Metodi
Una LG dovrebbe descrivere in maniera esplicita e dettagliata i metodi utilizzati per la sua produzione.
Una chiara descrizione del processo di produzione dovrebbe essere prevista da tutte le LG, all’interno della stessa LG o in un documento separato e citato (118). La descrizione del metodo di sviluppo della LG dovrebbe riflettere i requisiti riportati in questo articolo, includendo il processo di selezione dei componenti del GDG e del coordinatore, i metodi di revisione delle evidenze, il processo decisionale utilizzato dal GDG per valutare le evidenze e formulare le raccomandazioni, la diffusione e l’implementazione della LG, eventuali processi di revisione o di approvazione.
6. Revisione delle evidenze
I professionisti coinvolti nella produzione di LG dovrebbero utilizzare metodi sistematici per identificare e valutare le evidenze scientifiche.
Gli esperti concordano sul fatto che le LG affidabili si basano su revisioni sistematiche delle evidenze scientifiche di elevata qualità (2,51,103,119). Le revisioni sistematiche utilizzano metodi rigorosi per identificare i quesiti clinici, per definire i criteri di inclusione ed esclusione degli studi e per classificare la qualità delle evidenze. Il G-I-N ha già sviluppato specifici modelli per sintetizzare sia gli studi di accuratezza diagnostica, sia quelli che valutano l’efficacia degli interventi sanitari; sono in preparazione i modelli per gli studi di prognosi e per le valutazioni economiche (22). Alcuni articoli, tra cui il recente report dell’IOM, descrivono nei dettagli gli standard per realizzare una revisione sistematica di elevata qualità (25,120).
7. Raccomandazioni della linee guida
Le raccomandazioni di una LG dovrebbero essere formulate in maniera chiara ed essere basate su evidenze relative ai benefici, ai rischi e, se possibile, ai costi.
Le raccomandazioni devono essere affermazioni chiare ed evidence-based per fornire a chi utilizza le LG indicazioni precise per un’efficace erogazione dell’assistenza. Le raccomandazioni dovrebbero essere supportate dalla scrupolosa valutazione delle evidenze scientifiche; dall’entità di benefici e rischi e, se possibile dei costi; dagli aspetti relativi a risorse e fattibilità; da considerazioni sull’implementazione; dalle preferenze e aspettative di pazienti e caregivers; dagli aspetti etici e legali. Le raccomandazioni che riguardano interventi sanitari dovrebbero utilizzare un linguaggio non ambiguo, attivo, riflettendo il livello delle evidenze scientifiche. Una raccomandazione dovrebbe essere formulata in forma attiva e in modo da essere facilmente applicata (121). Le organizzazioni che producono LG dovrebbero utilizzare termini come “dovrebbe” o “raccomanda” e, tranne quando esiste una reale incertezza sulle prove di efficacia, dovrebbero evitare termini ed espressioni vaghe come “potrebbe”, “può” o “prendere in considerazione”, che non facilitano l’implementazione delle LG nella pratica clinica (122).
8. Rating delle evidenze e delle raccomandazioni
Una LG dovrebbe utilizzare un sistema di rating per classificare e comunicare sia la qualità e l’affidabilità delle evidenze, sia la forza delle raccomandazioni.
Le organizzazioni che producono LG dovrebbero utilizzare un approccio standardizzato per il grading e la sintesi delle evidenze. La forza delle raccomandazioni dovrebbe essere stabilita sulla base di numerose determinanti: qualità delle evidenze, entità dei benefici e dei rischi, consistenza, rilevanza clinica, generalizzabilità e applicabilità, preferenze del paziente. Una chiara identificazione della qualità delle evidenze e della forza delle raccomandazioni aumenta l’affidabilità delle LG e ne migliora l’implementazione (32,43,76).
Attualmente sono disponibili diversi sistemi di rating, tra cui il Grading of Recommendations Assessment, Development, and Evaluation (GRADE) system, sempre più utilizzato in tutto il mondo dalle organizzazioni che producono LG (34,66).
9. Peer review e consultazione degli stakeholders
Prima della sua pubblicazione una LG dovrebbe essere sottoposta a un processo di revisione da parte di stakeholders esterni.
Prima della sua pubblicazione, la LG dovrebbe essere sottoposta a revisione da parte di stakeholders esterni al GDG: esperti clinici e metodologi, rappresentanti dell’organizzazione sponsor, cittadini (4,101,105). Tale revisione, oltre ai contenuti della LG, dovrebbe prevedere anche una revisione metodologica sia dell’evidence-report, sia della LG. Nella selezione dei revisori è importante scegliere chi, verosimilmente, è in grado di fornire commenti basati sulla conoscenza scientifica e clinica, piuttosto che opinioni prive di fondamento (101). La LG deve riportare una sintesi del processo di revisione esterna.
10. Validità e aggiornamento della linea guida
Una LG dovrebbe prevedere un termine di validità e/o descrivere la strategia che il GDG prevede di utilizzare per aggiornare le raccomandazioni.
Le LG diventano obsolete con diversa velocità in relazione alla disponibilità di nuove evidenze, pertanto, è importante identificarne il termine di validità e la strategia di aggiornamento, se pianificata. Le organizzazioni che producono LG dovrebbero quindi stabilire le tempistiche di aggiornamento oppure un limite temporale oltre il quale, in assenza di aggiornamenti, la LG non dovrebbe più essere considerata valida.
11. Finanziamenti e sponsor
Una LG dovrebbe dichiarare i finanziamenti ricevuti sia per la revisione delle evidenze sia per la formulazione delle raccomandazioni.
La LG dovrebbe elencare eventuali sponsor, indicando quale ruolo hanno avuto nel processo di sviluppo della LG. Inoltre, eventuali onorari o finanziamenti erogati ai singoli componenti del GDG dovrebbero essere dichiarati esplicitamente.
CONCLUSIONI
Proponendo questi standard minimi il G-I-N promuove lo sviluppo di LG di elevata qualità al servizio dei pazienti. Poiché la nostra biblioteca elettronica contiene tutte le LG delle organizzazioni aderenti, è fondamentale che i membri del G-I-N considerino questo archivio una risorsa affidabile e preziosa. Anche se al momento, per essere incluse nell’archivio, non è necessario che le LG soddisfino i requisiti minimi presentati, questi dovrebbero aiutare produttori e utilizzatori di LG a valutarne punti di forza e limiti e, quindi, a individuare quali LG considerare affidabili.
Ci auguriamo che questo articolo promuova la discussione e un eventuale accordo tra la folta schiera di organizzazioni e professionisti impegnati nella produzione di LG, anche se chiaramente piccole variazioni locali potrebbero essere inevitabili e appropriate. Il G-I-N intende fornire una piattaforma per il dibattito internazionale e utilizzare l’infrastruttura dell’organizzazione per promuovere una discussione tra i nostri membri e giungere all’approvazione universale dei requisiti minimi per lo sviluppo di LG.
Affiliazione degli Autori
Amir Qaseem, American College of Physicians
Frode Forland, KIT Biomedical Research
Fergus Macbeth, National Institute for Health and Clinical Excellence
Günter Ollenschläger, Ärztliches Zentrum für Qualität in der Medizin
Sue Phillips, National Health and Medical Research Council
Philip van der Wees for the Board of Trustees of the Guidelines International Network, Department of Health Care Policy, Harvard Medical School
Contributo degli Autori
Ideazione e disegno dello studio: Amir Qaseem, Frode Forland, Fergus Macbeth, Philip van der Wees.
Acquisizione, analisi e interpretazione dei dati: Amir Qaseem, Frode Forland, Philip van der Wees.
Stesura dell’articolo: Amir Qaseem, Frode Forland, Fergus Macbeth, Sue Phillips, Philip van der Wees.
Revisione critica di importanti contributi intellettuali: Amir Qaseem, Frode Forland, Fergus Macbeth, Günter Ollenschläger, Sue Phillips, Philip van der Wees.
Approvazione finale della versione da pubblicare: Amir Qaseem, Frode Forland, Fergus Macbeth, Günter Ollenschläger, Sue Phillips, Philip van der Wees.
Disclosure dei conflitti di interesse
Disponibili a: www.acponline.org/authors/icmje/ConflictOfInterestForms.do?msNum_M11-2693.Indirizzo per la corrispondenza
aqaseem@acponline.orgProvenienza
Tradotto con permesso da: Qaseem A, Forland F, Macbeth F, Ollenschläger G, Phillips S, van der Wees P; Board of Trustees of the Guidelines International Network. Guidelines International Network: toward international standards for clinical practice guidelines. Ann Intern Med 2012;156:525-31. Disponibile a: http://annals.org/article.aspx?articleid=1103747 (ultimo accesso 24 ottobre 2012)
Disclaimer
Il Consiglio Direttivo del G-I-N 2010-2011 è responsabile del contenuto di questo articolo che non necessariamente riflette le opinioni di tutti i membri del G-I-N.
Consiglio Direttivo del G-I-N
Jako Burgers (Netherlands), Dave Davis (United States), Frode Forland (Norway), Minna Kaila (Finland), Fergus Macbeth (United Kingdom), Günter Ollenschläger (Germany), Sue Phillips (Australia), Keng Ho Pwee (Singapore), Amir Qaseem (United States), Rosa Rico (Spain), Jean Slutsky (United States), Sara Twaddle (United Kingdom), Philip van der Wees (Netherlands).
Fonti di finanziamento
Dal budget operativo del G-I-N.Ringraziamenti
Gli autori ringraziano il Consiglio Direttivo del G-I-N 2010–2011.
Note alla versione italiana
La Fondazione GIMBE ha sostenuto la traduzione italiana dell’articolo senza alcun supporto istituzionale o commerciale. L’American College of Physicians, che ha autorizzato la traduzione dell’articolo a fini non commerciali, non si assume alcuna responsabilità per l’accuratezza della traduzione.
Team che ha realizzato la versione italiana
Responsabile scientifico
Dott. Antonino Cartabellotta
Coordinamento editoriale
Dott. Marco Mosti
Traduzione
Dott.ssa Luigia Atorino, Dott.ssa Elena Cottafava
Revisione editoriale
Dott. Roberto Luceri,
Dott.ssa Francesca Torre
Pagina aggiornata il 24/ottobre/2012



